题目内容
7. 如图是某学校实验室从化学试剂商店买回的硫酸试剂瓶标签上的部分内容.现用该浓硫酸配制500mL浓度为1mol•L-1的稀硫酸.可供选用的仪器有:
如图是某学校实验室从化学试剂商店买回的硫酸试剂瓶标签上的部分内容.现用该浓硫酸配制500mL浓度为1mol•L-1的稀硫酸.可供选用的仪器有:①玻璃棒 ②烧杯 ③托盘天平 ④量筒 ⑤药匙 ⑥胶头滴管 ⑦500mL容量瓶 ⑧细口试剂瓶
请回答下列问题:
(1)配制500mL浓度为1mol•L-1的稀硫酸,需用量筒量取
上述浓硫酸体积为27.2mL.
(2)配制时,一般可分为以下几个步骤:①量取 ②计算 ③稀释 ④摇匀 ⑤转移
⑥洗涤 ⑦定容 ⑧冷却.其正确的操作顺序为②①③⑧⑤⑥⑦④,从上述所给仪器中选取
所需要的仪器有①②④⑥⑦⑧.
(3)实验中两次用到玻璃棒,其操作分别:搅拌,引流.
(4)在配制过程中,下列操作可引起所配溶液浓度偏高有ABE(填序号)
A.洗涤量取浓硫酸的量筒,并将洗涤液转移到容量瓶中
B.未等稀释后的硫酸溶液冷却至室温就转移到容量瓶中
C.转移前,容量瓶中含有少量蒸馏水
D.未洗涤稀释浓硫酸时用过的烧杯和玻璃棒
E.定容时,俯视刻度线
F.定容时加水超过了刻度线,马上用胶头滴管吸去多余的水.
分析 (1)依据C=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度;依据溶液稀释过程中溶质的物质的量不变计算需要浓硫酸体积;
(2)根据实验具体操作步骤有:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀等,据此排序,选择实验所需仪器;
(3)稀释浓硫酸用玻璃棒搅拌,移液时用玻璃棒引流;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)密度为1.84g/mL,质量分数为98%的浓硫酸,物质的量浓度C=$\frac{1000×98%×1.84}{98}$=18.4mol/L,设需要浓硫酸体积为V,则依据溶液稀释过程中溶质的物质的量不变计算得:18.4mol/L×V=1mol•L-1×500mL,解得V=27.2mL;
故答案为:27.2;
(2)用浓硫酸配制稀硫酸的一般操作步骤为:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀等,所以正确的操作步骤为:②①③⑧⑤⑥⑦④,用到的仪器:量筒、胶头滴管、烧杯、玻璃棒、500mL容量瓶,
故答案为:②①③⑧⑤⑥⑦④,①②④⑥⑦⑧;
(3)稀释浓硫酸用玻璃棒搅拌,移液时用玻璃棒引流;
故答案为:搅拌,引流;
(4)A.洗涤量取浓硫酸的量筒,并将洗涤液转移到容量瓶中,导致量取的浓硫酸体积偏大,溶质物质的量偏大,溶液浓度偏高,故A选;
B.未等稀释后的硫酸溶液冷却至室温就转移到容量瓶中,冷却后溶液体积偏小,溶液浓度偏高,故B选;
C.转移前,容量瓶中含有少量蒸馏水,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故C不选;
D.未洗涤稀释浓硫酸时用过的烧杯和玻璃棒,导致溶质部分损耗,溶质的物质的量偏小,溶液浓度偏低,故D不选;
E.定容时,俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故E选;
F.定容时加水超过了刻度线,马上用胶头滴管吸去多余的水,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故F不选;
故选:ABE.
点评 本题考查了配制一定物质的量浓度的溶液的方法判断,题目难度不大,要求学生熟练掌握配制一定物质的量浓度的溶液的步骤及正确操作方法.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| 选项 | 实验操作与现象 | 结论 |
| A | 向油脂皂化反应后的溶液中滴入酚酞,溶液变红 | 油脂已经完全皂化 |
| B | 蔗糖溶液在稀硫酸存在下水浴加热一段时间后,再与银氨溶液混合加热,有光亮的银生成 | 蔗糖溶液已经水解完全 |
| C | 向溶液X中滴入NaHCO3溶液,产生无色气体 | X中的溶质一定是酸 |
| D | 向鸡蛋清溶液中滴加醋酸铅溶液,产生白色沉淀,加水沉淀不消失 | 蛋白质发生了变性 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 在无色溶液中:NH4+、MnO4-、SO42-、CO32- | |
| B. | 在含大量 Ba2+的溶液中:NH4+、Na+、Cl-、OH- | |
| C. | 在强碱溶液中:Na+、K+、Cl-、SO32- | |
| D. | 在 pH=1 的溶液中:K+、Fe2+、Cl-、CH3COO- |
| A. | Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O | B. | 2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2 | ||
| C. | NaCl+AgNO3═NaNO3+AgCl↓ | D. | Zn+CuSO4═Cu+ZnSO4 |
 乙苯是一种用途广泛的有机原料,可制备多种化工产品.
乙苯是一种用途广泛的有机原料,可制备多种化工产品.(一)制备α-氯乙基苯的反应如下:
 +Cl2(g)$\stackrel{催化剂}{?}$
+Cl2(g)$\stackrel{催化剂}{?}$ -CH(g)+HCl(g)△H>0,T℃时,向一恒压密闭容器中充入等物质的量的乙苯气体和氯气发生上述反应(已排除其他反应干扰),测得乙苯物质的量分数随时间变化如表所示:
-CH(g)+HCl(g)△H>0,T℃时,向一恒压密闭容器中充入等物质的量的乙苯气体和氯气发生上述反应(已排除其他反应干扰),测得乙苯物质的量分数随时间变化如表所示:| 时间/(min) | 0 | 2 | 5 | 6 | 9 | 10 |
| χ(乙苯) | 0.5 | 0.25 | 0.1 | 0.1 | 0.05 | 0.05 |
(2)图中能正确反映平衡常数K随温度变化关系的曲线为b(填曲线标记字母),其判断理由是该反应正方向放热,升高温度使平衡正向移动,平衡常数增大.
(二)催化脱氢生产苯乙烯的反应如下:
 $\stackrel{催化剂}{?}$
$\stackrel{催化剂}{?}$ =CH2(g)+H2(g)△H=+124kJ/mol
=CH2(g)+H2(g)△H=+124kJ/mol(3)气相反应的化学平衡常数有多种表示方法,可用各气体物质的量分数代替浓度项表示平衡常数,写出上述反应的平衡常数表达式Kχ=$\frac{λ(氢气)•λ(苯乙烯)}{λ(乙苯)}$.(用符号χ表示气体物质的量分数).
(4)工业上,在恒压条件下进行上述反应时,将乙苯与水蒸气的混合气体通入反应器中(已知水蒸气不参与反应),加入水蒸气可以使乙苯的转化率增大,用化学平衡理论解释乙苯转化率增加的原因恒压条件下加入水蒸气,体积增大,使反应体系减压,平衡正向移动.
| A. | 2mol/L的稀盐酸1L | B. | 73gHCl | ||
| C. | 44.8LHCl | D. | 1.204×1024个HCl分子 |
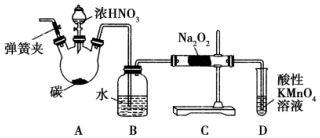 亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水为原料制备亚硝酸钠的装置如图所示.
亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水为原料制备亚硝酸钠的装置如图所示.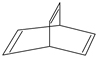 有机物的结构可用键线式简化表示,如CH3-CH═CH-CH3可表示为
有机物的结构可用键线式简化表示,如CH3-CH═CH-CH3可表示为 有一种有机物X的键线式如图所示.
有一种有机物X的键线式如图所示. .
. .
. .
.