题目内容
12.在高科技工业上,有的高分子材料能用在能量的转换上.如传感膜能把化学能转化为电能,热电膜能把热能转化为电能等,这种高分子材料是( )| A. | 高分子膜 | B. | 医用高分子材料 | C. | 生物高分子材料 | D. | 液晶高分子材料 |
分析 A、高分子膜用在能量的转换上;
B、医用高分子材料用于制造人工器官;
C、生物高分子材料用于生物技术;
D、液晶高分子材料具有液体和晶体的一些性质.
解答 解:A、传感膜能把化学能转化为电能,热电膜能把热能转化为电能等,这种高分子材料属于高分子膜,故A正确;
B、医用高分子材料用于制造人工器官,故B错误;
C、生物高分子材料用于生物技术,故C错误;
D、液晶高分子材料具有液体和晶体的一些性质,故D错误;
故选A.
点评 本题考查传统合成材料和供能高分子材料的区别,难度不大,注意基础知识的积累.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
2. 把分别盛有甲、乙、丙气体的试管到插入盛有水的烧杯中,一段时间后,观察到如图所示的现象,对甲、乙、丙气体的分析正确的是( )
把分别盛有甲、乙、丙气体的试管到插入盛有水的烧杯中,一段时间后,观察到如图所示的现象,对甲、乙、丙气体的分析正确的是( )
 把分别盛有甲、乙、丙气体的试管到插入盛有水的烧杯中,一段时间后,观察到如图所示的现象,对甲、乙、丙气体的分析正确的是( )
把分别盛有甲、乙、丙气体的试管到插入盛有水的烧杯中,一段时间后,观察到如图所示的现象,对甲、乙、丙气体的分析正确的是( )| A. | 甲、乙、丙气体都易溶于水 | B. | 乙气体比甲气体更易溶于水 | ||
| C. | 可以采用排水集气方法收集丙气体 | D. | 不可以用排空气法收集甲气体 |
3.下列有机物:①硝基苯;②环己烷;③甲苯;④苯磺酸;⑤溴苯;⑥异丙苯.其中不能由苯通过一步反应直接制取的是( )
| A. | ②④ | B. | ③ | C. | ①⑤②⑥ | D. | ③⑥ |
20.制备食用碘盐(KIO3)原理之一为:I2+2KClO3$\frac{\underline{\;873K\;}}{\;}$Cl2+2KIO3,下列说法不正确的是( )
| A. | KClO3和KIO3均属于离子化合物,含有离子键和共价键 | |
| B. | 为防止反应的尾气造成大气污染,可以用碱性溶液吸收尾气 | |
| C. | 反应过程中I2置换出Cl2,由此可推断非金属性I>Cl | |
| D. | 制备KIO3的反应中I2被氧化 |
7.表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填具体元素符号,下同).原子结构示意图为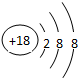 .元素⑩名称为溴单质与水反应化学方程式Br2+H2O=HBr+HBrO.
.元素⑩名称为溴单质与水反应化学方程式Br2+H2O=HBr+HBrO.
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是: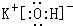 .
.
(3)②的最高价氧化物的化学式为N2O5写出其最高价氧化物的水化物稀溶液与足量的铁粉反应的离子方程式3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O.
(4)用电子式表示元素④与⑥的化合物的形成过程: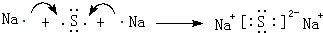 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.
(5)表示①与⑦、①与⑥形成的化合物的电子式 、
、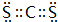 .
.
(6)③、⑥氢化物的沸点高低H2O的沸点高于H2S;原因H2O分子之间存在氢键
(7)④、⑥、⑦形成的简单离子的半径大小S2->Cl->Na+
(8)②和⑥形成的一种二元化合物具有色温效应,请相对分子质量在170~190之间,且⑥的质量分数约为70%.该化合物的化学式为S4N4.
(9)④和③两种元素形成含有非极性键的化合物化学式为Na2O2,鉴别该化合物中含④元素常用方法焰色反应;利用该化合物制取③单质的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .元素⑩名称为溴单质与水反应化学方程式Br2+H2O=HBr+HBrO.
.元素⑩名称为溴单质与水反应化学方程式Br2+H2O=HBr+HBrO.(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是:
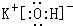 .
.(3)②的最高价氧化物的化学式为N2O5写出其最高价氧化物的水化物稀溶液与足量的铁粉反应的离子方程式3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O.
(4)用电子式表示元素④与⑥的化合物的形成过程:
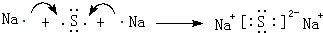 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.(5)表示①与⑦、①与⑥形成的化合物的电子式
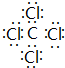 、
、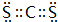 .
.(6)③、⑥氢化物的沸点高低H2O的沸点高于H2S;原因H2O分子之间存在氢键
(7)④、⑥、⑦形成的简单离子的半径大小S2->Cl->Na+
(8)②和⑥形成的一种二元化合物具有色温效应,请相对分子质量在170~190之间,且⑥的质量分数约为70%.该化合物的化学式为S4N4.
(9)④和③两种元素形成含有非极性键的化合物化学式为Na2O2,鉴别该化合物中含④元素常用方法焰色反应;利用该化合物制取③单质的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
17.检验1-溴丙烷中含有溴元素的实验步骤、操作和顺序正确的是:( )
①加入AgNO3溶液;②加入NaOH溶液;③加入适量HNO3;④加热;⑤取上层液体.
①加入AgNO3溶液;②加入NaOH溶液;③加入适量HNO3;④加热;⑤取上层液体.
| A. | ②④⑤③① | B. | ①③ | C. | ②④⑤① | D. | ①④ |
4.反应4A(s)+3B(g)═2C(g)+D(s),经2min,B的浓度减少0.6mol/L.对此化学反应速率的正确表示是( )
| A. | 用A表示的反应速率是0.4 mol/(L•min) | |
| B. | 分别用B、C表示反应的速率,其比值是3:2 | |
| C. | 在2 min末的反应速率,用B表示是0.3 mol/(L•min) | |
| D. | 在这2 min内B和C两物质浓度都逐渐减小 |
1.下列各组物质中,化学键类型相同的是( )
| A. | HClO和NaOH | B. | C02和H20 | C. | NaCl和HCl | D. | KOH和KCl |
2.设NA表示阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | 常温常压下,11.2 L CH4中含有的氢原子数为2NA | |
| B. | 1 mol Fe被氧化时,失去的电子数一定为2NA | |
| C. | 1 mol Na与足量水反应后转移的电子数为NA | |
| D. | 0.1 mol/L MgCl2溶液中Cl-离子数为0.2NA |