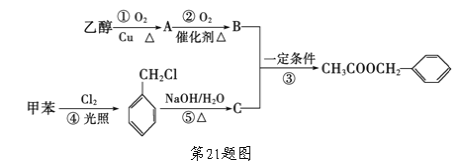
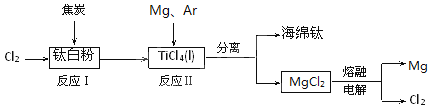
题目内容
【题目】为治理环境,减少雾霾,应采取措施减少二氧化硫、氮氧化物(NOx)等的排放量。
Ⅰ.处理NOx的一种方法是利用甲烷催化还原NOx。
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
②CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H2=-586.7kJ/mol
(1)若用4.48LCH4还原NO生成N2,则放出的热量为______kJ。(气体体积已折算为标准状况下)
Ⅱ.(2)NOx可用强碱溶液吸收产生硝酸盐。在酸性条件下,FeSO4溶液能将NO3-还原为NO,NO能与多余的FeSO4溶液作用生成棕色物质,这是检验NO3-的特征反应。写出该过程中产生NO的离子方程式: 。
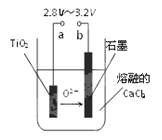
(3)用电化学处理含NO3-的废水,电解的原理如图1所示。则电解时阴极的电极反应式为 ;当电路中转移20 mol电子时,交换膜左侧溶液质量减少________g。



图1 图2 图3
Ⅲ.利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)![]() 5CO2(g)+I2(s)。不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 molCO,测得CO2的体积分数(φ)随时间(t)变化曲线如图2所示。
5CO2(g)+I2(s)。不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 molCO,测得CO2的体积分数(φ)随时间(t)变化曲线如图2所示。
(4)T1时,该反应的化学平衡常数的数值为 。
(5)下列说法不正确的是_______(填字母)。
A.容器内气体密度不变,表明反应达到平衡状态
B.两种温度下,c点时体系中混合气体的压强相等
C.d点时,在原容器中充入一定量氦气,CO的转化率不变
D.b点和d点时化学平衡常数的大小关系:Kb<Kd
Ⅳ.以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4通过反应CO2(g)+CH4(g)![]()
CH3COOH(g) △H<0直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图3所示。
(6)①250~300℃时,乙酸的生成速率减小的主要原因是 。
②工业生产中该反应的温度常选择250℃、不选择400℃,从综合经济效益考虑,其原因是 。
【答案】(1)119.88
(2)3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
(3)2NO3-+12H++10e-=N2↑+6H2O; 180
(4)1024
(5)BD
(6)①250℃~300℃时,催化剂的催化效率降低②250℃时,催化剂的催化效果最好,提高温度耗费较高的能量,并且低温条件有利于平衡向着正反应方向移动
【解析】
试题分析:
(1)根据盖斯定律可知②×2—①即可得到CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=—599.4kJ/mol。4.48LCH4的物质的量是0.2mol,所以还原NO生成N2放出的热量为599.4kJ/mol×0.2mol=119.88kJ。
(2)在酸性溶液中硝酸根氧化亚铁离子的方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O。
(3)电解时阴极得到电子,发生还原反应,则根据示意图可知硝酸根得到电子转化为氮气。由于存在质子交换膜,阳极氢氧根放电,水电离出的氢离子向阴极移动,所以阴极电极反应式为2NO3-+12H++10e-=N2↑+6H2O;当电路中转移20 mol电子时,根据电子得失守恒和2H2O+4e-=O2↑+4H+可知被电解的水是10mol,质量是180g,则交换膜左侧溶液质量减少180g。
(4)根据图像可知T1时,CO2的体积分数是0.8,则CO2是0.8×5mol=4mol,CO是1mol,所以根据化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值可知该反应的化学平衡常数的数值为![]() 。
。
(5)A.密度是混合气的质量和容器容积的比值,在反应过程中体积不被,但气体的质量变化,所以容器内气体密度不变,表明反应达到平衡状态,A正确;B.两种温度下,c点时体系中温度不同,所以混合气体的压强不相等,B错误;C.d点时,在原容器中充入一定量氦气,浓度不变,平衡不移动,所以CO的转化率不变,C正确;D.T2曲线首先平衡,说明温度是T2大于 T1。温度高CO2的含量降低,说明升高温度平衡向逆反应方向进行,则平衡常数减小,所以b点和d点时化学平衡常数的大小关系:Kb>Kd,D错误,答案选BD。
(6)①根据图像可知250—300℃时,乙酸的生成速率减小的主要原因是250℃~300℃时,催化剂的催化效率降低。②由于250℃时,催化剂的催化效果最好,提高温度耗费较高的能量,并且低温条件有利于平衡向着正反应方向移动,所以工业生产中该反应的温度常选择250℃、不选择400℃。

【题目】Ⅰ.Fe3+具有氧化性,实验室测定含碘废液中I-的含量的过程如下:量取25.00 mL废液于250 mL锥形瓶中,分别加入5 mL 2 mol·L-1 H2SO4和10 mL 20% Fe2(SO4)3溶液,摇匀。小火加热蒸发至碘完全升华,取下锥形瓶冷却后,加入几滴二苯胺磺酸钠(用作指示剂),用0.02500 mol·L-1标准K2Cr2O7溶液进行滴定到终点。重复3次,数据记录如下表:
次数 | 1 | 2 | 3 |
滴定体积/mL | 19.98 | 20.02 | 19.00 |
(1)在盛有废液的锥形瓶中先加入5 mL 2 mol·L-1 H2SO4的目的是
______________________________。(用离子方程式和语言叙述解释)
(2)上述过程中涉及的反应:①2Fe3++2I-===2Fe2++I2 ②______________________________。
(3)根据滴定有关数据,该废液中I-含量是_____g·L-1。
(4)在滴定过程中,下列操作(其他操作正确)会造成测定结果偏低的是___________。
A.终点读数时俯视读数,滴定前平视读数
B.锥形瓶水洗衣后未干燥
C.滴定管未用标准K2Cr2O7溶液润洗
D.盛标准K2Cr2O7溶液的滴定管,滴定前有气泡,滴定后无气泡
Ⅱ.Fe3+和Ag+的氧化性相对强弱一直是实验探究的热点。某学习小组同学设计如下实验:
实验编号 | 实验操作 | 现象 |
1 | 向10mL 3mol/L KNO3酸性溶液(pH=1)中插入一根洁净的Ag丝,并滴加NaCl溶液 | 无白色沉淀生成 |
2 | 向10mL 1mol/L AgNO3溶液中滴加2mL 0.1mol/L FeSO4溶液,振荡,再滴加酸性KMnO4溶液 | 紫红色不褪去 |
3 | 向10mL 1mol/L Fe(NO3)3酸性溶液(pH=1)中插入一根洁净的Ag丝,并滴加NaCl溶液 | 有白色沉淀生成 |
请回答:
(5)设计实验①的目的是______________________________。
(6)实验③可得出结论是______________________________。
(7)写出实验②中反应的离子方程式______________________________。
(8)根据以上实验,Fe3+和Ag+的氧化性相对强弱与离子____________________有关。