题目内容
常见元素及其化合物在生活生产中有着广泛的应用.
(1)铁红与铝粉发生铝热反应可用于焊接钢轨,其化学方程式为 ;铁红与KNO3、KOH混合加热共融,可制得高铁酸钾(K2FeO4),同时有KNO2生成,该反应的化学方程式为 ,K2FeO4具有强氧化性,是一种新型高效水处理剂,它在水处理过程中(铁元素被还原为+3价)的两个作用是 .
(2)几种常见的单质或化合物反应关系如图:
①若B为自然界中分布最广泛的液体,A常温下为黄绿色气体,C为非属氧化物,A、C均能使品红溶液褪色,相对分子质量E>D,则:A、C转化为D、E反应的化学方程式为 ,E的浓溶液与Cu反应的化学方程 .
②若A为最简单芳香烃,C为常温下为液态的非金属单质,D溶于水完全电离.常用的催化剂B为 ,该反应的反应类型为 ,除去E中混有少量C的通常采用的试剂为 ,方法为 .
(1)铁红与铝粉发生铝热反应可用于焊接钢轨,其化学方程式为
(2)几种常见的单质或化合物反应关系如图:

①若B为自然界中分布最广泛的液体,A常温下为黄绿色气体,C为非属氧化物,A、C均能使品红溶液褪色,相对分子质量E>D,则:A、C转化为D、E反应的化学方程式为
②若A为最简单芳香烃,C为常温下为液态的非金属单质,D溶于水完全电离.常用的催化剂B为
考点:无机物的推断
专题:推断题
分析:(1)氧化铁和铝发生铝热反应放出大量热,从而用于焊接钢轨;铁红与KNO3、KOH混合加热共融,可制得高铁酸钾(K2FeO4),同时有KNO2、水生成,根据反应物、生成物和反应条件书写方程式;
高铁酸钾具有强氧化性,其还原产物氢氧化铁胶体具有吸附性;
(2)①若B为自然界中分布最广泛的液体,则B是H2O,A常温下为黄绿色气体,则A是Cl2,C为非属氧化物,A、C均能使品红溶液褪色,则C是SO2,相对分子质量E>D,则D是HCl,E是H2SO4;
②若A为最简单芳香烃,则A是苯,C为常温下为液态的非金属单质,则C是Br2,苯和溴在铁作催化剂条件下发生取代反应生成溴苯和HBr,D溶于水完全电离,则D是HBr.
高铁酸钾具有强氧化性,其还原产物氢氧化铁胶体具有吸附性;
(2)①若B为自然界中分布最广泛的液体,则B是H2O,A常温下为黄绿色气体,则A是Cl2,C为非属氧化物,A、C均能使品红溶液褪色,则C是SO2,相对分子质量E>D,则D是HCl,E是H2SO4;
②若A为最简单芳香烃,则A是苯,C为常温下为液态的非金属单质,则C是Br2,苯和溴在铁作催化剂条件下发生取代反应生成溴苯和HBr,D溶于水完全电离,则D是HBr.
解答:
解:(1)高温条件下,铝和氧化铁发生铝热反应生成氧化铝和铁,反应方程式为:2Al+Fe2O3
Al2O3+2Fe;
加热条件下,氧化铁、硝酸钾、氢氧化钾反应生成高铁酸钾、亚硝酸钾和水,反应方程式为:Fe2O3+3KNO3+4KOH
2K2FeO4+3KNO2+2H2O;
在处理水过程中,高铁酸钾被还原生成铁离子,铁离子水解生成氢氧化铁胶体,胶体具有吸附性,所以能净水,高铁酸钾具有强氧化性,能杀菌消毒,所以其作用是K2FeO4具有强氧化性,可杀菌消毒,还原产物可吸附水中杂质,
故答案为:2Al+Fe2O3
Al2O3+2Fe;Fe2O3+3KNO3+4KOH
2K2FeO4+3KNO2+2H2O;K2FeO4具有强氧化性,可杀菌消毒;还原产物可吸附水中杂质;
(2)①若B为自然界中分布最广泛的液体,则B是H2O,A常温下为黄绿色气体,则A是Cl2,C为非属氧化物,A、C均能使品红溶液褪色,则C是SO2,相对分子质量E>D,则D是HCl,E是H2SO4;
氯气、二氧化硫和水反应生成盐酸、硫酸,所以A、C转化为D、E反应的化学方程式为Cl2+SO2+2H2O=2HCl+H2SO4,在加热条件下,铜和浓硫酸反应生成硫酸铜、二氧化硫和水,反应方程式为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,
故答案为:Cl2+SO2+2H2O=2HCl+H2SO4;Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;
②若A为最简单芳香烃,则A是苯,C为常温下为液态的非金属单质,则C是Br2,苯和溴在铁作催化剂条件下发生取代反应生成溴苯和HBr,D溶于水完全电离,则D是HBr,所以B是Fe,该反应属于取代反应,溴苯中含有溴时,溴能和氢氧化钠溶液反应,但溴苯和氢氧化钠溶液不反应,所以可以用氢氧化钠溶液洗涤,然后分液进行分离,故答案为:铁;取代反应;NaOH;洗涤、分液.
| ||
加热条件下,氧化铁、硝酸钾、氢氧化钾反应生成高铁酸钾、亚硝酸钾和水,反应方程式为:Fe2O3+3KNO3+4KOH
| ||
在处理水过程中,高铁酸钾被还原生成铁离子,铁离子水解生成氢氧化铁胶体,胶体具有吸附性,所以能净水,高铁酸钾具有强氧化性,能杀菌消毒,所以其作用是K2FeO4具有强氧化性,可杀菌消毒,还原产物可吸附水中杂质,
故答案为:2Al+Fe2O3
| ||
| ||
(2)①若B为自然界中分布最广泛的液体,则B是H2O,A常温下为黄绿色气体,则A是Cl2,C为非属氧化物,A、C均能使品红溶液褪色,则C是SO2,相对分子质量E>D,则D是HCl,E是H2SO4;
氯气、二氧化硫和水反应生成盐酸、硫酸,所以A、C转化为D、E反应的化学方程式为Cl2+SO2+2H2O=2HCl+H2SO4,在加热条件下,铜和浓硫酸反应生成硫酸铜、二氧化硫和水,反应方程式为:Cu+2H2SO4(浓)
| ||
故答案为:Cl2+SO2+2H2O=2HCl+H2SO4;Cu+2H2SO4(浓)
| ||
②若A为最简单芳香烃,则A是苯,C为常温下为液态的非金属单质,则C是Br2,苯和溴在铁作催化剂条件下发生取代反应生成溴苯和HBr,D溶于水完全电离,则D是HBr,所以B是Fe,该反应属于取代反应,溴苯中含有溴时,溴能和氢氧化钠溶液反应,但溴苯和氢氧化钠溶液不反应,所以可以用氢氧化钠溶液洗涤,然后分液进行分离,故答案为:铁;取代反应;NaOH;洗涤、分液.
点评:本题考查了物质的推断,涉及铝热反应、氧化还原反应、无机物的推断及有机物推断,明确物质的性质是解本题关键,根据物质的性质、特殊颜色等知识点来分析解答,同时考查学生综合知识掌握程度及灵活运用知识能力,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
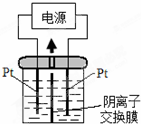 电解装置如图,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-=IO3-+5I-+3H2O,下列说法正确的是( )
电解装置如图,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-=IO3-+5I-+3H2O,下列说法正确的是( )| A、右侧发生的电极方程式:O2+4e-+2H2O=4OH- |
| B、电解槽内发生反应的总化学方程式是KI+3H2O=KIO3+3H2↑ |
| C、电解结束后,右侧溶液中不可能含有IO3- |
| D、如果用阳离子交换膜代替阴离子交换膜,电解槽内反应的总化学方程式不变 |
2013年CCTV-4报道地球空气温度和30年前相比升高1.5℃左右,为控制温室效应,可以将二氧化碳转化为化工原料,如在适当的条件下,二氧化碳和氢气以1:3的体积比进行反应,可生成某类重要的化工原料和水,则该类化工原料不可能是( )
| A、甲醇(CH3OH) |
| B、乙烯 |
| C、乙醇 |
| D、甲烷 |
将5.6g铁粉溶于过量的稀硫酸溶液中,在酸性条件下,用2.02g硝酸钾去氧化其中的Fe2+,待反应完全后,剩余的Fe2+需加入20mL 0.2mol?L-1的酸性高锰酸钾溶液恰好使其完全氧化为Fe3+(MnO4-被还原成Mn2+),则硝酸钾的还原产物的化学式为( )
| A、NO2 |
| B、NO |
| C、N2O |
| D、N2 |
若NA为阿伏加德罗常数,下列说法中正确的是( )
| A、常温常压下,11.2LN2和NO的混合气体所含的原子数为NA |
| B、1 mol C8H18分子中,共价键总数为25NA |
| C、在1molSiO2晶体中含 Si-O键的数目为2NA |
| D、含0.1 mol H2O2的水溶液跟MnO2充分作用,反应过程中转移的电子总数为0.2NA |

 如图是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6种元素的代号.
如图是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6种元素的代号.


