题目内容
6.实验室中,用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高纯氧化铁的步骤如图甲.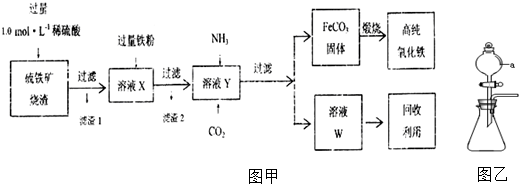
回答下列问题
(1)上述实验中,滤渣1的主要成分是SiO2,加入过量铁粉的作用是将溶液X中Fe3+全部还原为Fe2+,滤渣2中加入稀盐酸的离子方程式为Fe+2H+=Fe2++H2↑;检验溶液X中是否含有Fe3+的方法是用试管取溶液X少许,向其中滴加2~3滴KSCN溶液,若溶液变为血红色,则该溶液中含有
Fe3+,否则不含有.
(2)实验室欲用18.4mol•L-1的浓硫酸配制480mL 1.0mol•L-1的硫酸溶液,所用仪器除胶头滴管、量筒、烧杯、玻璃棒外,还有500mL容量瓶(填写仪器名称),需取用浓硫酸的体积为27.2 mL.
(3)实验室可用如图乙装置来制取NH3和CO2,a仪器名称为分液漏斗,制取氨气时,a中盛放的试剂的名称是浓氨水,锥形瓶中盛放试剂为CaO;制取二氧化碳时,a中盛放的是稀盐酸,锥形瓶中盛放的试剂为碳酸钙.
(4)煅烧FeCO3制取高纯氧化铁的化学方程式为4FeCO3+O2 $\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2,每生成1mol 氧化铁转移电子的物质的量为2 mol.
分析 向硫铁矿烧渣中加入硫酸,SiO2不与酸反应,氧化铁和氧化亚铁分别与硫酸发生复分解反应得到硫酸铁和硫酸亚铁,过滤后所得滤渣为SiO2,滤液A中加入过量铁粉将Fe3+还原为Fe2+,此反应既为化合反应又为氧化还原反应,过滤后在滤液中通入氨气和二氧化碳发生复分解反应生成FeCO3和硫酸铵,高温煅烧FeCO3发生氧化还原反应得Fe2O3,据此答题.
解答 解:向硫铁矿烧渣中加入硫酸,SiO2不与酸反应,氧化铁和氧化亚铁分别与硫酸发生复分解反应得到硫酸铁和硫酸亚铁,过滤后所得滤渣为SiO2,滤液A中加入过量铁粉将Fe3+还原为Fe2+,此反应既为化合反应又为氧化还原反应,过滤后在滤液中通入氨气和二氧化碳发生复分解反应生成FeCO3和硫酸铵,高温煅烧FeCO3发生氧化还原反应得Fe2O3,
(1)根据分析可知,滤渣1的主要成分是SiO2,溶液X中有铁离子,加入过量铁粉可以将铁离子还原为亚铁离子,滤渣2中主要是过量的铁粉,加入稀盐酸后铁与稀盐酸反应生成亚铁离子,反应的离子方程式为Fe+2H+=Fe2++H2↑,检验溶液X中是否含有Fe3+的方法是用试管取溶液X少许,向其中滴加2~3滴KSCN溶液,若溶液变为血红色,则该溶液中含有,
故答案为:SiO2;将溶液X中Fe3+全部还原为Fe2+;Fe+2H+=Fe2++H2↑;用试管取溶液X少许,向其中滴加2~3滴KSCN溶液,若溶液变为血红色,则该溶液中含有;
(2)实验室欲用18.4mol•L-1的浓硫酸配制480mL 1.0mol•L-1的硫酸溶液,所用仪器除胶头滴管、量筒、烧杯、玻璃棒外,还有500 mL容量瓶,需取用浓硫酸的体积为$\frac{1×500}{18.4}$mL=27.2mL,
故答案为:500 mL容量瓶;27.2;
(3)根据装置图可知,a仪器名称为分液漏斗,制取氨气时,用浓氨水与CaO作用制氨气,所以a中盛放的试剂的名称是浓氨水,锥形瓶中盛放试剂为CaO;制取二氧化碳时,用稀盐酸与碳酸钙反应,所以a中盛放的是稀盐酸,锥形瓶中盛放的试剂为碳酸钙,
故答案为:分液漏斗;浓氨水;碳酸钙;
(4)FeCO3高温煅烧可得Fe2O3,反应的方程式为4FeCO3+O2 $\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2,反应中铁由+2价升为+3价,所以每生成1mol氧化铁转移电子的物质的量为2mol,
故答案为:4FeCO3+O2 $\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2;2.
点评 本题考查尾气的处理、物质的制备和分离操作,侧重于学生分析能力、实验能力和综合运用化学知识能力的考查,为高考常见题型,题目难度中等,注意根据实验流程以及相关物质的性质解答该题.

| A. |  如图所示,测定中和反应的反应热时,大小两烧杯间填满碎泡沫塑料的作用是固定小烧杯 如图所示,测定中和反应的反应热时,大小两烧杯间填满碎泡沫塑料的作用是固定小烧杯 | |
| B. | 若用50 mL 0.55 mol•L-1的氢氧化钠溶液,分别与50 mL 0.50 mol•L-1的盐酸和50 mLA0.50 mol•L-1的硝酸充分反应,两反应测定的反应热不相等 | |
| C. | 实验时需要记录初始温度T1 和最高温度T2 | |
| D. | 做一次实验根据公式即可得出中和反应的反应热 |
| A. | 大量燃烧化石燃料排放的废气中含大量CO2、NOx,造成大气污染,从而使雨水的pH=5.6,形成酸雨 | |
| B. | 经过必要的化学变化能从海水中提取粗盐、Mg、Br2等物质 | |
| C. | 针对病毒性流感的扩散情况,要加强环境、个人等的消毒预防,其中消毒剂常选用含氯消毒剂、酒精、双氧水等适宜的物质 | |
| D. | 石油的分馏、石油裂解、煤的气化都包含化学变化 |
| A. | 滴加酚酞试液显红色的溶液中:K+、Na+、NO3-、Cl- | |
| B. | c(H+)=1×10-13 mol•L-1的溶液中:Mg2+、Na+、SO42-、NO3- | |
| C. | pH=1的溶液中:Na+、K+、MnO4-、SO2 | |
| D. | 0.1 mol•L-1FeCl3溶液中:Ba2+、Na+、SCN-、Br- |

| A. | 2SO3(g)?2SO2(g)+O2(g)△H>0 | B. | N2(g)+3H2(g)?2NH3(g)△H<0 | ||
| C. | 4NH3(g)+5O2(g)?4NO+6H2O(g)△H<0 | D. | H2(g)+CO(g)?C(s)+H2O(g)△H>0 |
| A. | Cl2溶于水:Cl2+H2O=2H++Cl-+ClO- | |
| B. | NaHCO3溶液中加入HCl:CO32-+2H+=CO2↑+H2O | |
| C. | 少量二氧化碳通入足量的NaOH溶液:CO2+OH-═HCO3- | |
| D. | Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-=5SO42-+2Mn2++3H2O |
| A. | 因为碳酸、氨水能够导电,所以液氨、二氧化碳是电解质 | |
| B. | 由同种元素组成的物质一定是纯净物 | |
| C. | 由C(石墨)═C(金刚石);△H=+1.90kJ•mol-1可知,石墨比金刚石稳定 | |
| D. | 在101kPa时,2g H2完全燃烧生成液态水,放出285.8 kJ热量,则表示氢气燃烧的热化学方程式为:2H2(g)+O2 (g)═2H2O(l);△H=-285.8kJ•mol-1 |
| A. | 点燃的酒精灯不小心打翻了,应立即用自来水灭火 | |
| B. | 皮肤沾上少量浓硫酸后,可先用大量水冲洗,再涂上稀碳酸氢钠溶液 | |
| C. | 在蒸馏实验中,加热一段时间后,忘了加入沸石,打开瓶塞立即加入沸石 | |
| D. | 冷凝管用作冷凝回流时,为防止有机物蒸汽逸出,可使用橡胶塞塞住顶端出口 |
 .
. ,名称是2-甲基-2-丁醇.
,名称是2-甲基-2-丁醇.