题目内容
下列事实不能作为实验判断依据的是( )
| A、钠和镁分别与冷水反应,判断钠和镁的金属活动性强弱 |
| B、在MgCl2与AlCl3溶液中分别加入过量的氨水,判断镁与铝的金属活动性强弱 |
| C、硫酸和硅酸钠溶液反应出白色沉淀,判断硫与硅的非金属活动性强弱 |
| D、Br2与I2分别与足量的H2反应,判断溴与碘的非金属活动性强弱 |
考点:非金属在元素周期表中的位置及其性质递变的规律,金属在元素周期表中的位置及其性质递变的规律
专题:元素周期律与元素周期表专题
分析:A、金属与水反应置换出氢气的难易程度,能判断金属性的强弱;
B、MgCl2与AlCl3溶液中分别加入过量的氨水,现象相同,不可以判断金属性的强弱;
C、非金属最高价氧化物对应的水化物的酸性,能判断非金属性的强弱;
D、非金属与氢气化合的难易程度,能判断非金属性的强弱.
B、MgCl2与AlCl3溶液中分别加入过量的氨水,现象相同,不可以判断金属性的强弱;
C、非金属最高价氧化物对应的水化物的酸性,能判断非金属性的强弱;
D、非金属与氢气化合的难易程度,能判断非金属性的强弱.
解答:
解:A、钠与冷水比镁与冷水反应剧烈,因此钠的金属性强于镁,故A正确;
B、在MgCl2与AlCl3溶液中分别加入过量的氨水,均生成白色沉淀,现象相同,不能判断镁与铝的金属活动性强弱,故B错误;
C、硫酸和硅酸钠溶液反应出白色沉淀,证明硫酸的酸性比硅酸强,所以能判断硫与硅的非金属活动性强弱,故C正确;
D、卤素单质与氢气化合越容易,非金属性越强,故D正确;
故选B.
B、在MgCl2与AlCl3溶液中分别加入过量的氨水,均生成白色沉淀,现象相同,不能判断镁与铝的金属活动性强弱,故B错误;
C、硫酸和硅酸钠溶液反应出白色沉淀,证明硫酸的酸性比硅酸强,所以能判断硫与硅的非金属活动性强弱,故C正确;
D、卤素单质与氢气化合越容易,非金属性越强,故D正确;
故选B.
点评:本题考查了判断非金属性及金属性强弱的方法,判断方法很多,注意对有关知识的积累,题目难度不大.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
乙烷在光照条件下与氯气发生取代反应,理论上得到的氯代物最多有几种( )
| A、5种 | B、6种 | C、8种 | D、9种 |
M2O3中M元素的化合价为( )
| A、+3 | B、+5 | C、+4 | D、+6 |
工业上用某种氧化铝矿石(含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
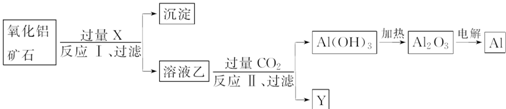
下列说法正确的是( )

下列说法正确的是( )
A、反应Ⅱ为CO2+2AlO
| ||
| B、CO2可以用H2SO4溶液或稀盐酸代替 | ||
| C、制取的铝单质与少量NaOH溶液反应的离子方程式为:Al+3OH-=Al(OH)3↓ | ||
| D、试剂X可以为NaOH溶液,沉淀中含有铁的化合物 |
叠氮酸(HN3)与醋酸酸性相似,下列叙述中正确的是( )
| A、HN3水溶液中微粒浓度大小顺序为:C(HN3)>C(H+)>C(N3-)>C(OH-) |
| B、HN3水溶液中微粒浓度大小顺序为:C(H+)>C(HN3)>C(N3-)>C(OH-) |
| C、NaN3水溶液中离子浓度大小顺序为:C(Na+)>C(N3-)>C(H+)>C(OH-) |
| D、HN3与NH3作用生成的产物是共价化合物 |
一定条件下,将5molH2和1molN2充入一密闭容器中,发生反应:N2+3H2?2NH3(各物质均为气态),达到平衡时,H2的转化率不可能是( )
| A、20% | B、35% |
| C、50% | D、65% |
为保护环境、防止污染,下列最理想的燃料是( )
| A、酒精 | B、氢气 | C、汽油 | D、无烟煤 |
下列反应的离子方程式书写正确的是( )
| A、氯气和水的反应:C12+H2O═2H++Clˉ+ClOˉ | ||||
| B、向碳酸氢钠溶液中加入过量氢氧化钠溶液:OHˉ+HCO3ˉ=CO2↑+H2O | ||||
| C、氯化铝溶液中滴加过量氨水:Al3++4NH3.H2O=AlO2-+4NH4++2H2O | ||||
D、惰性电极电解饱和氯化钠溶液:2Clˉ+2H2O
|
下列离子方程式的书写中,正确的是( )
A、过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO
| ||||
B、碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO-3+OH-=CO
| ||||
C、用铜作电极电解硫酸铜溶液:2Cu2++2H2O
| ||||
| D、硫化钠溶于水中:S2-+2H2O=H2S↑+2OH- |