题目内容
20.下列图示与对应的叙述相符的是( )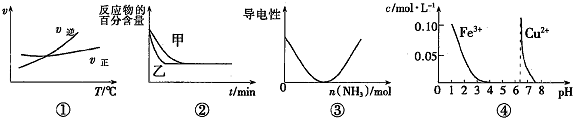
| A. | 据图①可判断可逆反应A2(g)+3B2(g)?2AB3(g)的△H>0 | |
| B. | 图②表示压强对可逆反应2A(g)+B(g)?3C(g)+D(s)的影响,乙的压强大 | |
| C. | 图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 | |
| D. | 据图④,若除去0.1 mol•L-1CuSO4溶液中混有的Fe3+,可向溶液中加入适量NaOH至pH约为7 |
分析 A、根据图①可知,交点之前,反应未达平衡,交点时处于平衡状态,交点后增大温度逆反应速率增大比正反应速率增大更多,平衡向逆反应移动,据此判断;
B、由图②可知,由甲到乙,到达平衡时间缩短,说明条件改变是乙的速率加快,平衡时反应物的转化率不变,改变条件变化不移动;
C、电解质溶液的导电能力与溶液离子的浓度有关,由图可知,随物质的加入导电能力降低到最低后又增大,据此结合选项判断;
D、由图可知,Fe3+在pH=4左右沉淀完全,此时铜离子不沉淀,故可以加入适量CuO,调节pH在4左右,除去除去CuSO4溶液中的Fe3+.
解答 解:A.根据图①可知,交点之前,反应未达平衡,交点时处于平衡状态,交点后增大温度逆反应速率增大比正反应速率增大更多,平衡向逆反应移动,升高温度平衡向吸热反应移动,故可判断可逆反应A2(g)+3B2(g)?2AB3(g)正反应是放热反应,故A错误;
B.由图②可知,由甲到乙,到达平衡时间缩短,说明条件改变是乙的速率加快,平衡时反应物的转化率不变,改变条件变化不移动,对可逆反应2A(g)+B(g)?3C(g)+D(s)来说,反应前后体积体积不变,所以增大压强平衡不移动,故B正确;
C.乙酸溶液中通入氨气生成乙酸铵,由弱电解质变为强电解质,溶液的导电能力增强,到最大值后,导电能力几乎不变,与图象不相符,故C错误;
D.由图可知,Fe3+在pH=4左右沉淀完全,此时铜离子不沉淀,故可以加入适量CuO或CuCO3或Cu(OH)2,调节pH在4左右,除去CuSO4溶液中的Fe3+,故D错误;
故选B.
点评 本题考查化学平衡的有关图象、电解质溶液导电能力、沉淀转化等,难度中等,是对知识的综合考查,注意分析图中曲线的变化特点.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
6.下列说法错误的是( )
| A. | 任何化学反应都有一定的限度,只是不同反应的限度不同罢了 | |
| B. | 化学反应的限度可通过改变条件而改变,如浓度、温度 | |
| C. | 可逆反应是指同一条件下,既可以向正反应方向进行,又可向逆反应方向进行的反应 | |
| D. | 当一个可逆反应进行到正反应速率与逆反应速率相等时,反应就停止了 |
8.下列物质中,属于强电解质的是( )
| A. | SO3 | B. | CH3COOH | C. | NH3 | D. | NaOH |
15.下列反应的离子方程式书写正确的是( )
| A. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 碳酸钙与盐酸反应 CO32-+2H+═CO2↑十H2O | |
| C. | 用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O═2HCO3-+SO32- | |
| D. | 氯化亚铁溶液中通入氯气:Fe2++Cl2═Fe3++2Cl- |
5.向下列各物质的水溶液中滴加稀硫酸或MgCl2溶液时,均有白色沉淀生成的是( )
| A. | Ba(NO3)2 | B. | KOH | C. | Ba(OH)2 | D. | Na2CO3 |
9.下列各组中的离子,在溶液中能大量共存的是( )
| A. | H+ Na+HCO3- Cl- | B. | Cu2+ Na+NO3- SO42- | ||
| C. | Mg2+ H+ SO42-OH- | D. | Ag+ Al3+ Cl-H+ |
10.已知 pOH值指溶液的碱度,以溶液中氢氧根离子浓度来表示,pOH=-lgc(OH-).则下列溶液,一定呈中性的是( )
| A. | c(H+)=1×10-7mol?L-1 的溶液 | B. | pH=pOH 的溶液 | ||
| C. | pH=14-pOH的溶液 | D. | pOH=0的溶液 |
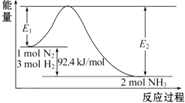 工业合成氨反应的能量变化如图所示.
工业合成氨反应的能量变化如图所示.