题目内容
H2SO3是二元弱酸,NaHSO3溶液呈酸性。在0.1 mol·L-1 NaHSO3溶液中,下列关系正确的是
A.c(HSO3—)>c(SO32—)>c(H2SO3)
B.c(Na+)=c(HSO3—)+2c(SO32—)+c(H2SO3)
C.c(Na+)=c(HSO3—)>c(H+)>c(OH-)
D.c(Na+)+c(H+)=c(HSO3—)+c(OH-)+c(SO32—)
A
【解析】
试题分析:NaHSO3溶液呈酸性,说明HSO3—电离强于水解,HSO3—是弱酸,不完全电离,所以A对;B是物料守恒,应为:c(Na+)=c(HSO3—)+c(SO32—)+c(H2SO3),B错;HSO3—要发生电离,c(Na+)与c(HSO3—)不相等,C错;D是电荷守恒,应为:c(Na+)+c(H+)=c(HSO3—)+c(OH-)+2c(SO32—),D错。
考点:盐类溶液酸碱性引起的原因、盐类水解的三个守恒以及离子浓度大小比较。

(16分)重铬酸钠(Na2Cr2O7?2H2O)俗称红矾钠,在工业上有广泛的用途。我国目前主要是以铬铁矿(主要成份为FeO?Cr2O3,还含有Al2O3、MgO、SiO2等杂质)为主要原料进行生产,其主要工艺流程如下:
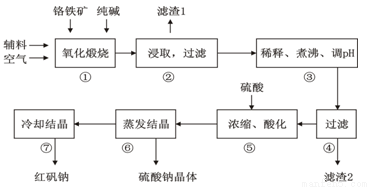
①中涉及的主要反应有:
主反应: 4FeO·Cr2O3+8Na2CO3+7O2 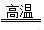 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
副反应:SiO2+Na2CO3  Na2SiO3+CO2↑、Al2O3+Na2CO3
Na2SiO3+CO2↑、Al2O3+Na2CO3  2NaAlO2+CO2↑
2NaAlO2+CO2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
完全沉淀时溶液pH | 4.7 | 3.7 | 11.2 | 5.6 |
试回答下列问题:
(1)“①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是 。
(2)“③”中调节pH至4.7,目的是 。
(3)“⑤”中加硫酸酸化的目的是使CrO42-转化为Cr2O72-,请写出该平衡转化的离子方程式: 。
(4)制取红矾钠后的废水中还含有少量的CrO42-,根据有关标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7 mol·L-1以下才能排放。含CrO42-的废水处理可用还原法:
CrO42- Cr3+
Cr3+ Cr(OH)3。绿矾还原CrO42-的离子方程式为:
Cr(OH)3。绿矾还原CrO42-的离子方程式为:
。
用该方法处理10 m3 CrO42-的物质的量浓度为1.5×10-3 mol·L-1的废水,至少需要绿矾(FeSO4?7H2O,相对分子质量为278)的质量是 Kg(保留两位小数)。
步骤⑦的操作是 。为进一步得到较为纯净的红矾钠的操作是
 cC ;ΔH= -Q kJ/mol;在某温度下的平衡常数为K(K≠1),反应热为Q。保持温度不变,将方程式的书写作如下改变,则Q和K数值的相应变化为
cC ;ΔH= -Q kJ/mol;在某温度下的平衡常数为K(K≠1),反应热为Q。保持温度不变,将方程式的书写作如下改变,则Q和K数值的相应变化为