题目内容
(16分)重铬酸钠(Na2Cr2O7?2H2O)俗称红矾钠,在工业上有广泛的用途。我国目前主要是以铬铁矿(主要成份为FeO?Cr2O3,还含有Al2O3、MgO、SiO2等杂质)为主要原料进行生产,其主要工艺流程如下:

①中涉及的主要反应有:
主反应: 4FeO·Cr2O3+8Na2CO3+7O2  8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
副反应:SiO2+Na2CO3  Na2SiO3+CO2↑、Al2O3+Na2CO3
Na2SiO3+CO2↑、Al2O3+Na2CO3  2NaAlO2+CO2↑
2NaAlO2+CO2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
完全沉淀时溶液pH | 4.7 | 3.7 | 11.2 | 5.6 |
试回答下列问题:
(1)“①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是 。
(2)“③”中调节pH至4.7,目的是 。
(3)“⑤”中加硫酸酸化的目的是使CrO42-转化为Cr2O72-,请写出该平衡转化的离子方程式: 。
(4)制取红矾钠后的废水中还含有少量的CrO42-,根据有关标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7 mol·L-1以下才能排放。含CrO42-的废水处理可用还原法:
CrO42- Cr3+
Cr3+ Cr(OH)3。绿矾还原CrO42-的离子方程式为:
Cr(OH)3。绿矾还原CrO42-的离子方程式为:
。
用该方法处理10 m3 CrO42-的物质的量浓度为1.5×10-3 mol·L-1的废水,至少需要绿矾(FeSO4?7H2O,相对分子质量为278)的质量是 Kg(保留两位小数)。
步骤⑦的操作是 。为进一步得到较为纯净的红矾钠的操作是
(1)使反应物接触更充分,加快反应速率,提高原料利用率
(2)除去溶液中的AlO2-、SiO32- (3)2CrO42-+2H+ Cr2O72-+H2O
Cr2O72-+H2O
(4)CrO42-+3Fe2++8H+=Cr3++3Fe3++4H2O 12.51
(5)过滤(或过滤、洗涤、干燥)。 重结晶
【解析】
试题分析:(1)反应①反应时不断搅拌目的是加快反应速率。
(2)氧化煅烧后过滤,滤液中阴离子主要含有CrO42-、AlO2-、SiO32-,由表格中信息可知,调节pH至4.7目的是除去溶液中AlO2-、SiO32-。
(3)CrO42-在酸性溶液中与H+生成Cr2O72-和水,是可逆反应,所以离子方程式为:
2CrO42-+2H+ Cr2O72-+H2O
Cr2O72-+H2O
(4)由流程知CrO42-与绿矾中的Fe2+发生了氧化还原反应,在酸性溶液中所以离子方程式为CrO42-+3Fe2++8H+=Cr3++3Fe3++4H2O 。根据方程式有
CrO42----------------- 3Fe2+
1 3
10×103×1.5×10-3 n 得 n =45mol
需要绿矾的质量m=45×278=12510g=12.51Kg
(5)冷却后晶体析出,需要过滤把溶液和晶体分离,要是晶体更纯就要进行重结晶。
考点:工艺流程

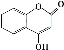 可用来制备抗凝血药,通过下列路线合成:
可用来制备抗凝血药,通过下列路线合成: