题目内容
已知X、Y、Z、W是元素周期表中短周期中的四种非金属元素,它们的原子序数依次增大,X元素的原子形成的阳离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍.试回答:
(1)写出下列元素的元素符号及电子排布式:
X Z
(2)工业上用X单质和Z单质在一定条件下反应生成化合物E,该反应的化学方程式为 .
(3)仅由X、Z、W三种元素组成的某种盐是一种速效肥料,根据VSEPR模型该盐中的阳离子的空间构型为(填名称) ,根据杂化轨道理论该盐中的阴离子空间构型应为(填名称) .
(4)这四种元素可组成原子个数比为5:1:1:3的化合物(按X、Y、Z、W的顺序)为 ,该化合物的水溶液与足量NaOH溶液在加热时反应的化学方程式为 .
(1)写出下列元素的元素符号及电子排布式:
X
(2)工业上用X单质和Z单质在一定条件下反应生成化合物E,该反应的化学方程式为
(3)仅由X、Z、W三种元素组成的某种盐是一种速效肥料,根据VSEPR模型该盐中的阳离子的空间构型为(填名称)
(4)这四种元素可组成原子个数比为5:1:1:3的化合物(按X、Y、Z、W的顺序)为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X元素的原子形成的阳离子就是一个质子,故X为H,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,且为短周期非金属元素,原子序数依次增大,Z为N,W为O,Y原子的最外层电子数是内层电子数的2倍所以Y为C,据此解答各小题即可.
解答:
解:X元素的原子形成的阳离子就是一个质子,故X为H,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,且为短周期非金属元素,原子序数依次增大,Z为N,W为O,Y原子的最外层电子数是内层电子数的2倍所以Y为C,
综上所述:X为氢,Y为碳,Z为氮,W为氧,
(1)X为H,其核外只有一个电子,核外电子排布式为:1s1,Z为氮,氮元素为7号元素,原子核外有7个电子,其电子排布式为:1s22s22P3,
故答案为:H、1s1;N、1s22s22P3;
(2)氢气和氮气在一定条件下反应生成化合物氨气,该反应的化学方程式为:N2+3H2
2NH3,故答案为:N2+3H2
2NH3;
(3)由H、N、O三种元素组成的一种速效肥料盐是硝酸铵,根据VSEPR模型该盐中的阳离子为铵根,铵根中N元素采取sp3杂化,空间构型为正四面体,NO3-中N原子形成3个δ键,没有孤电子对,则应为平面三角形,故答案为:正四面体;平面三角形;
(4)H、C、N、O四种元素可组成原子个数比为5:1:1:3的化合物,该化合物为NH4HCO3与足量浓NaOH溶液反应生成碳酸钠、氨气与水,反应离子方程式为:NH4++HCO3-+2OH-=NH3↑+2H2O+CO32-,
故答案为:NH4HCO3;NH4++HCO3-+2OH-=NH3↑+2H2O+CO32-.
综上所述:X为氢,Y为碳,Z为氮,W为氧,
(1)X为H,其核外只有一个电子,核外电子排布式为:1s1,Z为氮,氮元素为7号元素,原子核外有7个电子,其电子排布式为:1s22s22P3,
故答案为:H、1s1;N、1s22s22P3;
(2)氢气和氮气在一定条件下反应生成化合物氨气,该反应的化学方程式为:N2+3H2
| 高温高压 |
| 催化剂 |
| 高温高压 |
| 催化剂 |
(3)由H、N、O三种元素组成的一种速效肥料盐是硝酸铵,根据VSEPR模型该盐中的阳离子为铵根,铵根中N元素采取sp3杂化,空间构型为正四面体,NO3-中N原子形成3个δ键,没有孤电子对,则应为平面三角形,故答案为:正四面体;平面三角形;
(4)H、C、N、O四种元素可组成原子个数比为5:1:1:3的化合物,该化合物为NH4HCO3与足量浓NaOH溶液反应生成碳酸钠、氨气与水,反应离子方程式为:NH4++HCO3-+2OH-=NH3↑+2H2O+CO32-,
故答案为:NH4HCO3;NH4++HCO3-+2OH-=NH3↑+2H2O+CO32-.
点评:本题考查元素的推断、核外电子排布式规律、微粒空间结构等,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
关于反应Fe2O3+3CO
2Fe+3CO2的下列说法中正确的是( )
①Fe2O3发生氧化反应
②Fe2O3是氧化剂
③Fe是还原产物
④CO具有氧化性
⑤该反应属于置换反应.
| ||
①Fe2O3发生氧化反应
②Fe2O3是氧化剂
③Fe是还原产物
④CO具有氧化性
⑤该反应属于置换反应.
| A、②③⑤ | B、只有①② |
| C、只有②③ | D、①③④ |
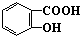 对下列物质有如图的转化关系:
对下列物质有如图的转化关系: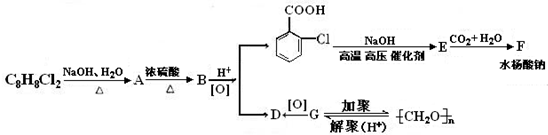
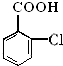 生成E的反应中所消耗NaOH的物质的量是
生成E的反应中所消耗NaOH的物质的量是