题目内容
“化学是以实验为基础的科学”.在实验中感知化学知识是学好化学的关键.请针对以下实验回答问题:
【实验一】室温下,将a g Ba(OH)2?8H2O粉末和a/2g NH4Cl粉末置于锥形瓶中,并将锥形瓶置于滴有几滴水的玻璃片上,迅速搅拌,然后用带有玻璃导管的单孔橡胶塞塞紧瓶口,如图1所示.
(1)该实验的现象是 .
(2)若将锥形瓶内物质加热产生的气体通入AlCl3溶液中,可观察到有白色沉淀生成,反应的离子方程式是 ;分离出纯净的白色沉淀的主要操作有 .
【实验二】如图2所示,将适量的蔗糖放入小烧杯中,滴入几滴水,搅拌均匀.然后加入适量浓硫酸,迅速搅拌.反应放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀.
(1)蔗糖逐渐变黑,体现了浓硫酸的 性.
(2)湿润的品红试纸产生的现象是 ,产生该现象的物质是 ,产生这一物质的化学方程式是 ,其中浓硫酸的作用是 .
(3)蘸有氢氧化钠溶液的棉花的作用是 ,发生反应的离子方程式 .
【实验一】室温下,将a g Ba(OH)2?8H2O粉末和a/2g NH4Cl粉末置于锥形瓶中,并将锥形瓶置于滴有几滴水的玻璃片上,迅速搅拌,然后用带有玻璃导管的单孔橡胶塞塞紧瓶口,如图1所示.
(1)该实验的现象是
(2)若将锥形瓶内物质加热产生的气体通入AlCl3溶液中,可观察到有白色沉淀生成,反应的离子方程式是

【实验二】如图2所示,将适量的蔗糖放入小烧杯中,滴入几滴水,搅拌均匀.然后加入适量浓硫酸,迅速搅拌.反应放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀.
(1)蔗糖逐渐变黑,体现了浓硫酸的
(2)湿润的品红试纸产生的现象是
(3)蘸有氢氧化钠溶液的棉花的作用是
考点:探究吸热反应和放热反应,浓硫酸的性质实验
专题:实验设计题
分析:实验一(1)氯化铵铵盐和强碱氢氧化钡的反应生成氨气、水及氯化钡,该反应过程中吸热热量,据此解答反应现象;
(2)将锥形瓶内物质加热产生的气体为氨气,氨气与氯化铝溶液反应生成氢氧化铝沉淀和氯化铵,据此写出反应的离子方程式;氢氧化铝难溶于水,据此判断分离出氢氧化铝的存在方法;
实验二(1)根据浓硫酸的三大特性进行解答;
(2)根据浓硫酸具有强氧化性,发生反应C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O生成产物进行解答;
(3)二氧化硫有毒,不能直接排放到大气中,所以用氢氧化钠溶液吸收.
(2)将锥形瓶内物质加热产生的气体为氨气,氨气与氯化铝溶液反应生成氢氧化铝沉淀和氯化铵,据此写出反应的离子方程式;氢氧化铝难溶于水,据此判断分离出氢氧化铝的存在方法;
实验二(1)根据浓硫酸的三大特性进行解答;
(2)根据浓硫酸具有强氧化性,发生反应C+2H2SO4(浓)
| ||
(3)二氧化硫有毒,不能直接排放到大气中,所以用氢氧化钠溶液吸收.
解答:
解:实验一(1)氯化铵铵盐和强碱氢氧化钡的反应为:Ba(OH)2?8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑,该反应是吸热反应,温度降低能让水结冰,玻璃片与锥形瓶粘在一起,导致烧杯和玻璃片粘在一起,同时生成的氨气具有刺激性气味,
故答案为:锥形瓶壁变凉,玻璃片与锥形瓶粘在一起,有刺激性气味气体放出;
(2)若将锥形瓶内物质加热产生的气体通入AlCl3溶液中,氨气与铝离子反应生成氢氧化铝沉淀,反应的离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,所以察到有白色沉淀生成,可以通过过滤、洗涤和干燥等操作方法分离出白色沉淀氢氧化铝,
故答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;过滤、洗涤、干燥;
实验二(1)蔗糖逐渐变黑,蔗糖中的HO元素被浓硫酸脱出,体现了浓硫酸的脱水性,故答案为:脱水;
(2)浓硫酸具有强氧化性,能够与碳在加热条件下反应生成二氧化碳、二氧化硫和水,反应的化学方程式为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O,二氧化硫具有漂白性,能够使品红褪色,浓硫酸在反应中作强氧化剂,
故答案为:湿润的品红试纸褪色;SO2;C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O;强氧化剂;
(3)碳与浓硫酸反应生成的有毒的二氧化硫气体,所以需要用蘸有氢氧化钠溶液的棉花吸收SO2,防止污染空气;二氧化硫与氢氧化钠溶液反应的离子方程式为:SO2+2OH-=SO32-+H2O,
故答案为:吸收SO2,防止污染空气;SO2+2OH-=SO32-+H2O.
故答案为:锥形瓶壁变凉,玻璃片与锥形瓶粘在一起,有刺激性气味气体放出;
(2)若将锥形瓶内物质加热产生的气体通入AlCl3溶液中,氨气与铝离子反应生成氢氧化铝沉淀,反应的离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,所以察到有白色沉淀生成,可以通过过滤、洗涤和干燥等操作方法分离出白色沉淀氢氧化铝,
故答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;过滤、洗涤、干燥;
实验二(1)蔗糖逐渐变黑,蔗糖中的HO元素被浓硫酸脱出,体现了浓硫酸的脱水性,故答案为:脱水;
(2)浓硫酸具有强氧化性,能够与碳在加热条件下反应生成二氧化碳、二氧化硫和水,反应的化学方程式为:C+2H2SO4(浓)
| ||
故答案为:湿润的品红试纸褪色;SO2;C+2H2SO4(浓)
| ||
(3)碳与浓硫酸反应生成的有毒的二氧化硫气体,所以需要用蘸有氢氧化钠溶液的棉花吸收SO2,防止污染空气;二氧化硫与氢氧化钠溶液反应的离子方程式为:SO2+2OH-=SO32-+H2O,
故答案为:吸收SO2,防止污染空气;SO2+2OH-=SO32-+H2O.
点评:本题考查了探究吸热反应的方法、浓硫酸的性质,题目难度中等,注意掌握探究吸热反应、放热反应的方法,明确浓硫酸的三大特性:吸水性、脱水性、强氧化性,试题有利于培养学生灵活应用所学知识的能力.

练习册系列答案
相关题目
下面有机物的同系物中,完全燃烧产生的水和二氧化碳的物质的量之比恒定的:( )
(a)饱和一元醇,
(b)饱和一元醛,
(c)饱和一元羧酸,
(d)饱和一元醇和饱和一元羧酸生成的酯,
(e)乙炔的同系物,
(f)苯的同系物.
(a)饱和一元醇,
(b)饱和一元醛,
(c)饱和一元羧酸,
(d)饱和一元醇和饱和一元羧酸生成的酯,
(e)乙炔的同系物,
(f)苯的同系物.
| A、(b)(c) |
| B、(a)(d) |
| C、(b)(c)(d) |
| D、(b)(c)(d)(e)(f) |
在KBr和KI混合溶液中,通入足量的氯气,反应后蒸干溶液、灼烧,残留物是( )
| A、KCl |
| B、KCl和KBr |
| C、KCl和KI |
| D、KCl、Br2和I2 |
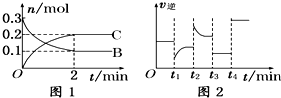 一定温度下,在2L的密闭容器中发生如下反应:A(s)+2B(g)?2C(g)△H<0,反应过程中B、C的物质的量随时间变化的关系如图1;反应达平衡后在t1、t2、t3、t4时分别都只改变了一种条件,逆反应速率随时间变化的关系如图2.下列有关说法正确的是( )
一定温度下,在2L的密闭容器中发生如下反应:A(s)+2B(g)?2C(g)△H<0,反应过程中B、C的物质的量随时间变化的关系如图1;反应达平衡后在t1、t2、t3、t4时分别都只改变了一种条件,逆反应速率随时间变化的关系如图2.下列有关说法正确的是( )| A、t1时改变的条件可能是升高温度 |
| B、t2时改变的条件可能是增大B的浓度 |
| C、t3时改变的条件可能是加压,此时c(B)不变 |
| D、t4时可能是使用了催化剂,此时c(B)不变 |
下列各组混合气体分别通入水中,其中一种气体消失另一种气体体积增大的是( )
| A、HCl、CO2 |
| B、HCl、O2 |
| C、NO、NO2 |
| D、H2S、SO2 |
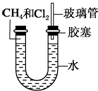 如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解度可以忽略.将封闭有甲烷和氯气混合气体的装置放置在有光亮的地方,让混合气体缓慢地反应一段时间.
如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解度可以忽略.将封闭有甲烷和氯气混合气体的装置放置在有光亮的地方,让混合气体缓慢地反应一段时间.