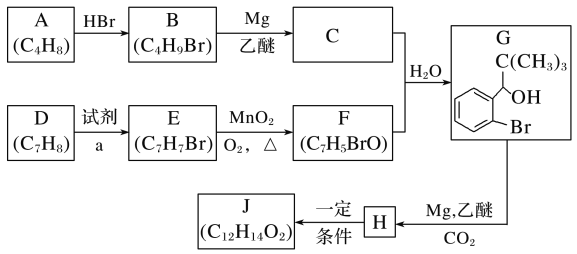
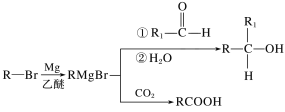
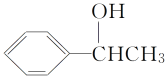
��Ŀ����
����Ŀ��KIO3��һ����Ҫ�������������Ϊʳ���еIJ�������ش��������⣺
(1)KIO3�Ļ�ѧ������_______��
(2)������KClO3���������Ʊ�KIO3������������ͼ��ʾ��

���ữ��Ӧ�����ò�����KH(IO3)2��Cl2��KCl������Cl2�����õķ�����________������Һ���е�������Ҫ��_______������pH���з�����Ӧ�Ļ�ѧ����ʽΪ__________��
(3)KClO3Ҳ�ɲ�������ⷨ���Ʊ���װ����ͼ��ʾ��

��д�����ʱ�����ĵ缫��Ӧʽ______��
�ڵ�������ͨ�������ӽ���Ĥ��������ҪΪ_________����Ǩ�Ʒ�����_____________��
��������ⷨ����ȣ���KClO3������������Ҫ����֮����__________(д��һ��)��
���𰸡������ ���� KCl KH(IO3)2+KOH=2KIO3+H2O 2H2O+2e-=2OH-+H2�� K+ a��b ����Cl2��������Ⱦ����
��������
(1)KIO3�Ļ�ѧ�����ǵ���أ�
(2)�����ڼ��ȵĹ�������ˮ�е��ܽ�Ƚ��ͣ��ɲ�ȡ�˷��������壬ʵ����������KClO3�������Ʊ�KIO3����Ӧ����KClO3��I2��������������ClO3-��������I2����IO3-��������֪��������ԭ���ﺬ��Cl2��Cl-������Cl2��ᾧ����ӦΪKCl���൱���dz��Ӳ��裬����pH�����в�����KIO3����KH(IO3)2��Ӧת���������ݴ˷�����
(3)�ٵ�������ΪKOH��Һ���������Һ�ʼ��ԣ���������������ԭ��Ӧ������ӦΪH2Oת��ΪH2���ݴ�д�������缫��Ӧ��
�ڸ�Ĥ�������ӽ���Ĥ�������ӽ���ֻ����������ͨ�������ع���ʱ���������������ƶ���
�۵�ⷨ�����У�����������ӦI2-10e-+12OH-=2IO3-+6H2O���Ʊ��õ�KIO3����������װ��û�в��������������еIJ�����Cl2����û�в�����Ⱦ�����������ж����塣
(1)KIO3�Ļ�ѧ�����ǵ���أ�
(2)������ˮ�е��ܽ�����¶ȵ����߶����ͣ����Կɲ�ȡ���ȷ����������壬����Cl2Ӧ���õķ����Ǽ��ȣ�
������֪��������ԭ���ﺬ��Cl2��Cl-������Cl2��ᾧ����ӦΪKCl���൱���dz��Ӳ��裬������Һ���е�������Ҫ��KCl��
����pH�����в���KIO3����KH(IO3)2ת��������������pH���з�����Ӧ�Ļ�ѧ����ʽΪ��KH(IO3)2+KOH=2KIO3+H2O��
(3)�ٵ�������ΪKOH��Һ���������Һ�ʼ��ԣ������������õ����ӣ�������ԭ��Ӧ����ʱ��H2O��õ���ת��ΪH2���������ĵ缫��ӦΪ��2H2O+2e-=2OH-+H2����
�ڸ�Ĥ�������ӽ���Ĥ��ֻ����������ͨ��������ͨ�������ӽ���Ĥ������ӦΪK+��
���ع���ʱ�������������������ƶ������K+���ƶ�����ӦΪ��a��b��
�۵�ⷨ�����У�����������ӦI2-10e-+12OH-=2IO3-+6H2O���Ʊ�KIO3������װ�ò�����������H2�����������������Cl2��Cl2���ж��������Ⱦ����������������IJ���֮���Dz���Cl2����Ⱦ������

 ���������ν�ϵ�д�
���������ν�ϵ�д�����Ŀ���±�Ϊ���ֶ�����Ԫ�ص����ʣ�
Ԫ�ر�� | �� | �� | �� | �� | �� | �� | �� | �� |
ԭ�Ӱ뾶 | 66 | 160 | 152 | 110 | 99 | 186 | 70 | 88 |
����ϼ� |
|
|
|
|
|
|
| |
��ͻ��ϼ� |
|
|
|
|
�����й�����Ԫ�ص�˵����ȷ����
A.Ԫ�آݵ��⻯��ķе����Ԫ�آٵ��⻯��ķе�
B.�ڢ��γɵĻ�����Ϊ���ۻ�����
C.��������Ԫ���У�����������Ӧˮ�����������ǿ����Ԫ�آ�
D.Ԫ�آ�λ�����ڱ��е�3���ڢ�A��