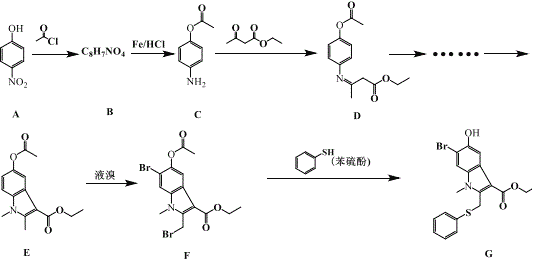
题目内容
【题目】下列物质在水溶液中的电离方程式书写错误的是( )
A.NaHCO3=Na++H++![]() B.NH4NO3=
B.NH4NO3=![]()
![]()
C.NaHSO4=Na++H++![]() D.Ba(OH)2=Ba2++2OH﹣
D.Ba(OH)2=Ba2++2OH﹣
【答案】A
【解析】
A.碳酸氢钠在溶液中完全电离出钠离子和碳酸氢根离子,碳酸氢根离子是弱酸的酸式酸根离子,不能拆开,正确的离子方程式为NaHCO3=Na++![]() ,故A错误,但符合题意;
,故A错误,但符合题意;
B.硝酸铵在溶液中完全电离,其电离方程式为NH4NO3=![]()
![]() ,故B正确,但不符合题意;
,故B正确,但不符合题意;
C.硫酸氢钠为强电解质,在溶液中完全电离,其电离方程式为NaHSO4=Na++H++![]() ,故C正确,但不符合题意;
,故C正确,但不符合题意;
D.氢氧化钡为强电解质,在溶液中完全电离出钡离子和氢氧根离子,其电离方程式为Ba(OH)2=Ba2++2OH﹣,故D正确,但不符合题意;
故选:A。

练习册系列答案
相关题目
【题目】现有部分短周期元素的相关信息如下表所示:
元素代号 |
|
|
|
|
相关信息 | 海水中质量分数最高的元素 | 其简单氢化物的水溶液呈碱性 |
| 其简单离子是第3周期元素的简单离子中半径最小的 |
(1)![]() 在元素周期表中位于第______周期第______族;元素
在元素周期表中位于第______周期第______族;元素![]() 与元素
与元素![]() 相比,金属性较强的是______(用元素符号表示),下列能证明这一事实的是______(填序号)。
相比,金属性较强的是______(用元素符号表示),下列能证明这一事实的是______(填序号)。
a.![]() 单质的熔点比
单质的熔点比![]() 单质的低
单质的低
b.在化合物中![]() 的化合价比
的化合价比![]() 低
低
c.![]() 的单质能与冷水剧烈反应而
的单质能与冷水剧烈反应而![]() 的单质不能
的单质不能
d.![]() 、
、![]() 同周期且
同周期且![]() 在
在![]() 的右侧
的右侧
(2)![]() 与
与![]() 元素可形成含有共价键的常见二元离子化合物,该化合物的化学式为______,该化合物中离子键与共价键的数目比为______。
元素可形成含有共价键的常见二元离子化合物,该化合物的化学式为______,该化合物中离子键与共价键的数目比为______。
(3)![]() 、
、![]() 的氢化物
的氢化物![]() 、
、![]() 在一定条件下反应可得到一种单质和一种常温下为液体的物质,试写出该反应的化学方程式:__________________________________________。
在一定条件下反应可得到一种单质和一种常温下为液体的物质,试写出该反应的化学方程式:__________________________________________。