题目内容
(13分)有A、B、C、D、E五种元素,其相关信息如下:
元素 | 相关信息 |
A | A原子的1s轨道上只有1个电子 |
B | B是电负性最大的元素 |
C | C基态原子的2p轨道中有3个未成对电子 |
D | D是主族元素且与E同周期,其最外能层上有2个运动状态不同的电子 |
E | E的+1价离子的M能层中所有能级各轨道都有电子且没有未成对电子 |
请回答下列问题:
(1)写出元素E的基态原子的电子排布式_________________。
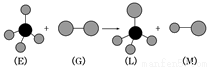
(2)CA3分子中C原子的杂化类型是________;在元素E的硫酸盐溶液中逐渐通入CA3,可以观察到的实验现象是 ,发生的有关反应的离子方程式为 。
(3)C与A还可形成C2A4、CA5等化合物,二者都能与盐酸反应。则C2A4与盐酸反应的离子方程式为 。CA5还可与水反应产生无色气体,且所得溶液显碱性,则CA5的电子式为 ,与水反应的化学方程式 。
(4)A、C、E三种元素可形成[E(CA3)4]2+,其中存在的化学键类型有____(填序号);
1mol该离子中含有 个σ键。
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为_________(填序号)。
a.平面正方形 B.正四面体 c.三角锥形 D.V形
(5)B与D可形成离子化合物,其晶胞结构如图所示。

其中D离子的配位数为 ________,该晶体的化学式为__________。
(13分) (1)[Ar]3d104s1(1分)。
(2) sp3杂化(1分);先有蓝色沉淀产生,然后沉淀逐渐溶解得到深蓝色溶液(1分),
Cu2+ + 2NH3·H2O = Cu(OH)2↓ + 2NH4+(1分)、
Cu(OH)2 + 4NH3·H2O = [Cu(NH3)4]2++2OH—+4H2O(1分)注:NH3·H2O用NH3表示同样给分。
(3) N2H4 + 2H+ = [N2H6]2+(1分)。 (1分),NH4H + H2O = NH3·H2O + H2↑(1分)。
(1分),NH4H + H2O = NH3·H2O + H2↑(1分)。
(4) ①③(1分);16NA(或16×6.02×1023)(1分)。a(1分)。
(5) 8(1分),CaF2(1分)。
【解析】
试题分析:A原子的1s轨道上只有1个电子,则A为H;B是电负性最大的元素,B为F;C基态原子的2p轨道中有3个未成对电子,C为N;E的+1价离子的M能层中所有能级各轨道都有电子且没有未成对电子,E为Cu,D是主族元素且与E同周期,其最外能层上有2个运动状态不同的电子,D为Ca ;(1)Cu的基态原子的电子排布式为[Ar]3d104s1 ;(2)NH3分子中N原子的杂化类型是sp3杂化, 在硫酸铜溶液中逐渐通入NH3,先生成氢氧化铜,然后氢氧化铜溶解得到深蓝色溶液,有关反应的离子方程式为Cu2+ + 2NH3·H2O = Cu(OH)2↓ + 2NH4+(1分)、Cu(OH)2 + 4NH3·H2O = [Cu(NH3)4]2++2OH—+4H2O ;(3) N2H4与盐酸反应的离子方程式为N2H4 + 2H+ = [N2H6]2+。NH5的电子式为 ,与水反应的化学方程式NH4H + H2O = NH3·H2O + H2↑(4) [Cu(NH3)4]2+中铜与氨之间形成四个配位键,氨分子内形成三个共价键,共16个σ键;[Cu(NH3)2]2+Cl2若为立体结构只有一种结构,若为平面结构,两个氯在边上或对角线上两种结构;则[Cu(NH3)4]2+的空间构型为平面正方形;(5)F与Ca形成离子化合物是体心立方结构,Ca离子的配位数为8,根据均摊法可知化学式为CaF2 。
,与水反应的化学方程式NH4H + H2O = NH3·H2O + H2↑(4) [Cu(NH3)4]2+中铜与氨之间形成四个配位键,氨分子内形成三个共价键,共16个σ键;[Cu(NH3)2]2+Cl2若为立体结构只有一种结构,若为平面结构,两个氯在边上或对角线上两种结构;则[Cu(NH3)4]2+的空间构型为平面正方形;(5)F与Ca形成离子化合物是体心立方结构,Ca离子的配位数为8,根据均摊法可知化学式为CaF2 。
考点:原子结构、元素周期律、元素周期表、化学键

 2C(g)+2D(g),在不同情况下测得反应速率如下,其中反应速率最快的是
2C(g)+2D(g),在不同情况下测得反应速率如下,其中反应速率最快的是