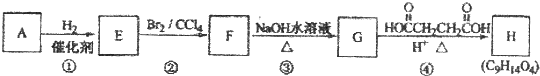
题目内容
1.短周期主族元素A、B、C、D、E的原子序数依次增大,它们的原子核外电子层之和为13;B的化合物种类繁多,数目庞大;C、D是空气中含量最多的两种元素,D、E两种元素的单质反应可以生成两种不同的离子化合物.F是同周期元素中原子半径最小的.试回答以下问题:(1)写出D与E以1:1的原子个数比形成的化合物的电子式:
 .
.(2)B、D形成的化合物BD2中存在的化学键为共价键(填“离子”或“共价”,下同).A、B、C、D 四种元素形成的化合物CA5BD3为离子化合物.
(3)A、C、D、E的原子半径由大到小的顺序是Na>N>O>H(用元素符号表示).
(4)B的非金属性弱于F的非金属性(填“强”或“弱”).
(5)B的最高价氧化物的水化物的酸性弱于C的最高价氧化物的水化物的酸性(填“强”或“弱”).
分析 B形成的化合物种类繁多,确定B为C元素;根据C、D为空气中含量最多的两种元素,且A、B、C、D、E、F的原子序数依次增大,所以C为N元素,D为O元素;D、E形成两种不同的离子化合物,则E为Na;F为同周期半径最小的元素,E、F同周期,所以F为Cl元素;它们的原子核外电子层数之和为13,则A为H元素,然后结合元素及其单质、化合物的性质来解答.
解答 解:B形成的化合物种类繁多,确定B为C元素;根据C、D为空气中含量最多的两种元素,且A、B、C、D、E、F的原子序数依次增大,所以C为N元素,D为O元素;D、E形成两种不同的离子化合物,则E为Na;则A为原子序数小于C的元素,结合题目知为H,
(1)Na元素与O按原子个数为1:1形成的化合物为Na2O2,其电子式为 ,故答案为:
,故答案为: ;
;
(2)B、D形成的化合物CO2中存在的化学键为共价键;H、C、N、O四种元素形成的化合物CA5BD3为NH5CO3,化学式为:NH4HCO3,即碳酸氢铵,碳酸氢铵含有离子键属于离子化合物,故答案为:共价;离子;
(3)A、C、D、E分别为H、N、O、Na,H是周期表中半径最小的,同周期原子序数越大半径越小,所以N>O,不同周期电子层越多半径越大,所以原子半径Na>N,则由大到小的顺序为:Na>N>O>H;故答案为:Na>N>O>H;
(4)元素B和F的分别为C、Cl,非金属性C比Cl弱,高氯酸能制备碳酸,则高氯酸的酸性大于碳酸,即非金属性,Cl大于C,故答案为:弱;
(5)元素的非金属性越强,其最高价氧化物的水化物的酸性越强,非金属性N>C,故硝酸的酸性强于碳酸,故答案为:弱.
点评 本题考查原子结构与元素周期律,元素的推断是解答本题的关键,熟悉化学用语的使用即可解答,题目难度中等.

练习册系列答案
相关题目
4.下列分子中,中心原子以sp3杂化且属于极性分子的是( )
| A. | CCl4 | B. | BF3 | C. | CO | D. | NH3 |
6.下列说法不正确的是( )
| A. | 在粗盐提纯中,当加热到蒸发皿中有较多固体析出,残留少量液体时,停止加热,用余热将液体蒸干 | |
| B. | 当振荡分液漏斗中的混合溶液时,须用一只手压住分液漏斗的玻璃塞,另一只手握住旋塞,将分液漏斗倒转过来,用力振荡 | |
| C. | 从加碘盐中获取碘单质的操作步骤为:溶解-萃取-分液-蒸馏 | |
| D. | 实验过程中若皮肤不慎沾上少量碱液,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗 |
13.下列分子中的所有碳原子不可能处在同一平面上的是( )
① ②
② ③
③ ④
④ ⑤CH3CH=CHCH3.
⑤CH3CH=CHCH3.
①
 ②
② ③
③ ④
④ ⑤CH3CH=CHCH3.
⑤CH3CH=CHCH3.| A. | ②③ | B. | ①④ | C. | ①②④ | D. | ①⑤ |
10.运用化学反应原理研究NH3的性质具有重要意义.请回答下列问题:
(1)利用对苯醌质子电池可检测氨气,其电池反应原理为2NH3+ (对苯醌)═N2H4+
(对苯醌)═N2H4+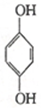 (对苯酚),N2H4的结构式为
(对苯酚),N2H4的结构式为 ,该电池正极的电极反应式为
,该电池正极的电极反应式为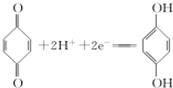 .
.
(2)25℃时,将nmol•L-1的氨水与0.1mol•L-1的盐酸等体积混合.
①若混合溶液中c(NH4+)=c(Cl-),则溶液的pH=7.
②若混合溶液中c(NH4+)>c(Cl-),则反应的情况可能为a.
a、盐酸不足,氨水剩余 b、氨水与盐酸恰好反应 c、盐酸过量
(3)在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3N2(g)?2NH3(g)△H=bkJ•mol-1,其化学平衡常数K与温度的关系如下:
①写出该反应的化学平衡常数的表达式:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$,b小于(填“大于”“小于”或“等于”)0.
②400℃时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时刻该反应的u正(N2)小于(填“大于”“小于”或“等于”)u正(N2).
(4)已知:①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
写出氨高温催化氧化的热化学方程式:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8KJ/mol.
(1)利用对苯醌质子电池可检测氨气,其电池反应原理为2NH3+
 (对苯醌)═N2H4+
(对苯醌)═N2H4+ (对苯酚),N2H4的结构式为
(对苯酚),N2H4的结构式为 ,该电池正极的电极反应式为
,该电池正极的电极反应式为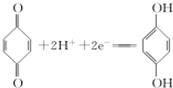 .
.(2)25℃时,将nmol•L-1的氨水与0.1mol•L-1的盐酸等体积混合.
①若混合溶液中c(NH4+)=c(Cl-),则溶液的pH=7.
②若混合溶液中c(NH4+)>c(Cl-),则反应的情况可能为a.
a、盐酸不足,氨水剩余 b、氨水与盐酸恰好反应 c、盐酸过量
(3)在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3N2(g)?2NH3(g)△H=bkJ•mol-1,其化学平衡常数K与温度的关系如下:
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
②400℃时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时刻该反应的u正(N2)小于(填“大于”“小于”或“等于”)u正(N2).
(4)已知:①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
写出氨高温催化氧化的热化学方程式:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8KJ/mol.
11.如图图象与对应的叙述相符的是( )

| A. | 图I表示盐酸滴加到0.1mol/L某碱溶液中得到的滴定曲线,由图I可知二者恰好中和时,所得溶液的pH=7 | |
| B. | 图II表示一定条件下进行的反应2SO2+O2?2SO3△H<0各成分的物质的量变化,t2时刻改变的条件可能是加压或降低温度 | |
| C. | 图III表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20ml Ba(OH)2溶液时,沉淀是Al(OH)3与BaSO4的混合物 | |
| D. | 图IV表示向一定体积含等浓度NH4Cl、AlCl3、MgCl2混合溶液中逐渐加入NaOH溶液至过量的过程中,生成沉淀的质量与加入NaOH溶液的体积之间的关系 |
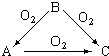 常温下某淡黄色固体单质A,与它的气态氢化物B和氧化物C之间,有如图的转变关系,请回答:(1)A是S、B是H2S、C是SO2.
常温下某淡黄色固体单质A,与它的气态氢化物B和氧化物C之间,有如图的转变关系,请回答:(1)A是S、B是H2S、C是SO2.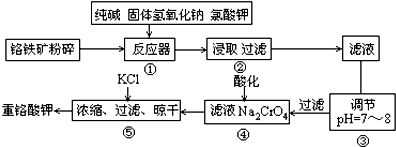
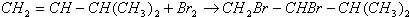 ;
;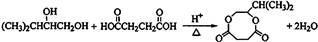 .
.