题目内容
下列说法正确的是( )
| A、氧化还原反应的本质是反应前后有元素化合价的升降 |
| B、Ag++Cl-=AgCl↓ 的反应属于化合反应 |
| C、从1 L 1 mol/L的H2SO4溶液中取出10 mL该溶液,其中H+浓度为2 mol/L |
| D、晶体硅是制造光导纤维的原料 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:A.氧化还原反应的本质为电子的转移;
B.为溶液中的离子反应;
C.1 mol/L的H2SO4溶液中H+浓度为2 mol/L,且溶液具有均一性;
D.Si作半导体材料或太阳能电池材料.
B.为溶液中的离子反应;
C.1 mol/L的H2SO4溶液中H+浓度为2 mol/L,且溶液具有均一性;
D.Si作半导体材料或太阳能电池材料.
解答:
解:A.氧化还原反应的本质为电子的转移,其特征为元素化合价的升降,故A错误;
B.为溶液中的离子反应,由生成沉淀可知,符合复分解反应发生的条件,为溶液中的复分解反应,故B错误;
C.1 mol/L的H2SO4溶液中H+浓度为2 mol/L,且溶液具有均一性,则1L溶液中取出10mL,溶液不变,故C正确;
D.Si作半导体材料或太阳能电池材料,而二氧化硅是制造光导纤维的原料,故D错误;
故选C.
B.为溶液中的离子反应,由生成沉淀可知,符合复分解反应发生的条件,为溶液中的复分解反应,故B错误;
C.1 mol/L的H2SO4溶液中H+浓度为2 mol/L,且溶液具有均一性,则1L溶液中取出10mL,溶液不变,故C正确;
D.Si作半导体材料或太阳能电池材料,而二氧化硅是制造光导纤维的原料,故D错误;
故选C.
点评:本题考查较综合,涉及氧化还原反应、离子反应、溶液的浓度及物质性质与性质等,为高考常见的冷拼型习题,把握物质的性质、反应原理为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
下列说法正确的是( )
| A、糖类、油脂、蛋白质在一定条件都能发生水解反应 |
| B、苯只能发生取代反应,不能发生加成反应 |
| C、棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2O |
| D、溴乙烷与NaOH的乙醇溶液共热生成乙烯 |
向一定量的饱和石灰水中加入少量CaO固体,恢复到原来温度时,下列说法正确的是( )
| A、溶液中的Ca2+总数不变 |
| B、溶液中 OH-数目增加 |
| C、溶质的物质的量浓度不变 |
| D、溶液的质量不变 |
化合物L是一种能使人及动物的内分泌系统发生紊乱导致生育及繁殖异常的环境激素,它在一定条件下水解可生成双酚A和有机酸M.下列关于L、双酚A和M的叙述中正确的是( )


| A、1mol L分别与足量NaOH和H2反应,最多可消耗2mol NaOH和8mol H2 |
| B、有机酸M与油酸互为同系物,双酚A与苯酚互为同系物 |
| C、与M含相同官能团的同分异构体还有2种 |
| D、等物质的量的L、A和M 与足量浓溴水发生反应,消耗Br2的量之比为1:2:1 |
常温下,下列溶液的pH或微粒的物质的量浓度关系不正确的是( )
| A、在醋酸的稀溶液中存在电离平衡:CH3COOH?CH3COO-+H+,加水一定能使电离平衡右移,氢氧根离子浓度增大 |
| B、pH=2的一元强酸HR溶液与pH=12的NaOH溶液等体积混合后,混合液的pH等于7,则反应后的混合液:c(R- )=c(Na+) |
| C、把pH=2的 HCl和CH3COOH分别加水稀释相同倍数后,CH3COOH的pH比HCl的小 |
| D、某物质的溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,则该溶液的pH一定为14-a |
下列叙述中错误的是( )
| A、离子键没有方向性和饱和性,共价键有方向性和饱和性 |
| B、配位键在形成时,由成键双方各提供一个电子形成共用电子对 |
| C、金属键的实质是金属中的“自由电子”与金属阳离子形成的一种强烈的相互作用 |
| D、金属键中的“自由电子”为金属阳离子共用 |
下列关于化学反应方向的叙述中正确的是( )
| A、△H<0,△S>0的反应肯定是自发的 |
| B、△H<0,△S<0的反应肯定是自发的 |
| C、△H>0,△S>0的反应肯定是自发的 |
| D、△H>0,△S<0的反应肯定是自发的 |
从海水中提取部分物质的过程如图所示
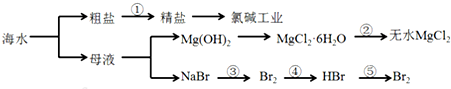
下列有关说法不正确的是( )

下列有关说法不正确的是( )
| A、从能量转换角度来看,框图中的氯碱工业是一个将电能转化为化学能的过程 |
| B、过程②中结晶出的MgCl2?6H2O要在HCl氛围中加热脱水制得无水MgCl2 |
| C、经过③④实现了溴元素的富集 |
| D、电解MgCl2溶液制取Mg单质 |
