题目内容
14.设NA为阿伏伽德罗常数的数值.下列说法正确的是( )| A. | 2gD2O与2gH218O含有的中子数均为NA | |
| B. | 1L0.1mol•L-1Na2S溶液中S2-和H2S的数目之和为0.1NA | |
| C. | 漂白粉中加入浓盐酸,每生成1molCl2,转移的电子数2NA | |
| D. | 常温下,将1molNO2气体加压生成N2O4的分子数为0.5NA |
分析 A.D2O与H218O分子中都含有10个中子,其摩尔质量都是20g/mol;
B.硫离子水解生成硫氢根离子,硫氢根离子水解生成硫化氢;
C.依据方程式Ca(ClO)2+4HCl(浓)→CaCl2+2Cl2↑+2H2O解答;
D.二氧化氮生成四氧化二氮为可逆反应,依据可逆反应不能进行到底特点解答.
解答 解:A.2gD2O与2gH218O物质的量都是0.1mol,含有的中子物质的量都是1mol,个数均为NA,故A正确;
B.硫离子水解生成硫氢根离子,硫氢根离子水解生成硫化氢,依据硫原子个数守恒可知,1L0.1mol•L-1Na2S溶液中S2-和H2S的数目之和小于0.1NA,故B错误;
C.依据方程式Ca(ClO)2+4HCl(浓)→CaCl2+2Cl2↑+2H2O可知,生成2mol氯气,盐酸失去2mol电子需要2mol盐酸作还原剂,生成1mol氯气,所以其转移电子数是NA,故C错误;
D.二氧化氮生成四氧化二氮为可逆反应,依据可逆反应不能进行到底,则1molNO2气体加压生成N2O4的分子数小于0.5NA,故D错误;
故选:A.
点评 本题考查阿伏加德罗常数的有关计算和判断,明确盐类水解规律、氧化还原电得失电子守恒规律、可逆反应特点是解题关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.下列说法正确的是( )
| A. | 煤是无机化合物,天然气和石油是有机化合物 | |
| B. | 利用化石燃料燃烧放出的热量使分解产生氢气,是氢能开发的研究方向 | |
| C. | 化学电源放电、植物光合作用都能发生化学变化,并伴随能量的转化 | |
| D. | 若化学过程中断开化学键放出的能量大于形成化学键所吸收的能量,则反应放热 |
5.如表实验操作正确且能达到预期目的是( )
| 实验目的 | 操作 | |
| A | 欲证明CH2=CHCHO中含有碳碳双键 | 滴入酸性KMnO4溶液 |
| B | 欲除去苯中混有的苯酚 | 向混合液中加入浓溴水,充分反应后,过滤 |
| C | 证明SO2具有漂白性 | 将SO2通入酸性KMnO4溶液中 |
| D | 确定碳和硅两元素非金属性强弱 | 测同温同浓度Na2CO3和Na2SiO3水溶液的pH |
| A. | A | B. | B | C. | C | D. | D |
2.下列说法正确的是( )
| A. | 工业上生产玻璃、水泥、漂白粉均需要用石灰石为原料 | |
| B. | 用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同 | |
| C. | 大分子化合物油脂在人体内水解为氨基酸和甘油等小分子才能被吸收 | |
| D. | 司母戊鼎、定远舰甲板、有机玻璃等原材料属于合金 |
19.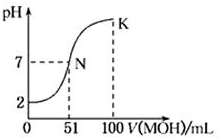 常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况.下列说法中正确的是( )
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况.下列说法中正确的是( )
 常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况.下列说法中正确的是( )
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况.下列说法中正确的是( )| A. | HA为一元强酸,MOH为一元弱碱 | |
| B. | 滴入MOH溶液的体积为50 mL时,c(M+)>c(A-) | |
| C. | N点水的电离程度大于K点水的电离程度 | |
| D. | K点时,c(MOH)+c(M+)=0.02 mol•L-1 |
6.X、Y、Z、W属于短周期主族元素.X元素的原子半径最大,Y元素的最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m-n,W元素与Z元素同主族,R元素原子与Y元素原子核外电子数之比为2:1,下列说法中错误的是( )
| A. | X与Y形成的两种化合物中阴阳离子个数比为1:2 | |
| B. | Y分别与Z、W、R以两种元素组成的常见化合物有5种 | |
| C. | Y的氢化物比R的氢化物稳定,Y的氢化物熔沸点比R的氢化物熔沸点低 | |
| D. | Z、W、R的最高价氧化物对应水化物的酸性强弱顺序是R>W>Z |
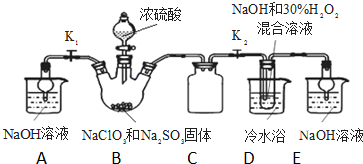 亚氯酸钠(NaClO2)是重要漂白剂.探究小组开展如下实验,回答下列问题:
亚氯酸钠(NaClO2)是重要漂白剂.探究小组开展如下实验,回答下列问题:
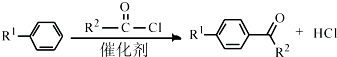 (R1、R2代表烷基)
(R1、R2代表烷基)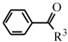 +ClCH2COOR4+R4ONa→
+ClCH2COOR4+R4ONa→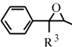 COOR4+R4OH+NaCl(R3、R4代表烷基)
COOR4+R4OH+NaCl(R3、R4代表烷基)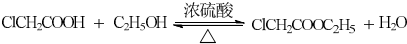 .
. .
.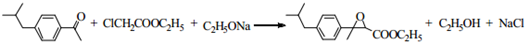 .
.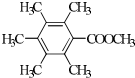 、
、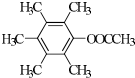 、
、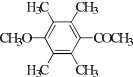 .
.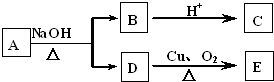 某有机物A的分子式为C6H12O2,已知A~E有如图转化关系,且D不与Na2CO3溶液反应,C、E均能发生银镜反应,则A的结构可能有( )
某有机物A的分子式为C6H12O2,已知A~E有如图转化关系,且D不与Na2CO3溶液反应,C、E均能发生银镜反应,则A的结构可能有( )