题目内容
下列各组物质相互作用时,生成物随反应条件或反应物的量变化而变化的是( )
| A、Na和O2 |
| B、AlCl3和NaOH |
| C、NaHCO3和NaOH |
| D、Al(OH)3和氨水 |
考点:钠的化学性质,钠的重要化合物,镁、铝的重要化合物
专题:几种重要的金属及其化合物
分析:A、根据Na和O2反应的条件的不同,生成物也不同;
B、氯化铝和少量氢氧化钠溶液反应生成白色沉淀,和过量氢氧化钠溶液反应时先生成沉淀后沉淀溶解;
C、根据NaHCO3和NaOH反应的产物是碳酸盐;
D、氢氧化铝是两性氢氧化物,溶于强酸强碱,不溶于弱酸弱碱;
B、氯化铝和少量氢氧化钠溶液反应生成白色沉淀,和过量氢氧化钠溶液反应时先生成沉淀后沉淀溶解;
C、根据NaHCO3和NaOH反应的产物是碳酸盐;
D、氢氧化铝是两性氢氧化物,溶于强酸强碱,不溶于弱酸弱碱;
解答:
解:A、A、Na和O2在常温下反应生成氧化钠,Na和O2在加热条件下反应生成氧化钠,反应条件改变,会引起产物的种类改变,故A符合;
B、氯化铝和少量氢氧化钠溶液反应生成氢氧化铝白色沉淀,和过量氢氧化钠溶液反应时,先生成氢氧化铝沉淀,然后氢氧化铝再和氢氧化钠反应生成可溶性的偏铝酸钠,溶液又变澄清,故B符合;
C、NaHCO3和NaOH反应的产物是碳酸钠,生成物不随反应条件或反应物的用量变化而变化,故C不符合;
D、氢氧化铝是两性氢氧化物,溶于强酸强碱,不溶于弱酸弱碱,Al(OH)3和氨水不反应,故D不符合;
故选AB.
B、氯化铝和少量氢氧化钠溶液反应生成氢氧化铝白色沉淀,和过量氢氧化钠溶液反应时,先生成氢氧化铝沉淀,然后氢氧化铝再和氢氧化钠反应生成可溶性的偏铝酸钠,溶液又变澄清,故B符合;
C、NaHCO3和NaOH反应的产物是碳酸钠,生成物不随反应条件或反应物的用量变化而变化,故C不符合;
D、氢氧化铝是两性氢氧化物,溶于强酸强碱,不溶于弱酸弱碱,Al(OH)3和氨水不反应,故D不符合;
故选AB.
点评:本题是对物质之间反应物量的不同导致的结果不同的考查,解题的关键是掌握具体的反应产物的不同,属于物质之间反应的探讨,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
对于反应8NH3+3Cl2=N2+6NH4Cl,下列说法正确的是( )
| A、N2是氧化产物,且还原剂与氧化剂物质的量之比是8:3 |
| B、N2是氧化产物,且还原剂与氧化剂物质的量之比是2:3 |
| C、NH4Cl是氧化产物,且还原剂与氧化剂物质的量之比是8:3 |
| D、NH4Cl是氧化产物,且还原剂与氧化剂物质的量之比是2:3 |
下列各组生活现象中,前者为物理变化,后者属于化学变化的一组是( )
| A、蜡烛燃烧,葡萄酒化 |
| B、汽车爆胎、米饭煮糊 |
| C、水果腐烂、蔗糖溶解 |
| D、玻璃破碎、鲜肉冷冻 |
下列说法不正确的是( )
| A、日常所见的云、雾、烟都属于胶体,其分散剂都是空气 |
| B、CO高温下与Fe3O4的反应,既是氧化还原反应,又是置换反应 |
| C、冰和干冰既是化合物,又是纯净物 |
| D、不锈钢和目前流通的硬币都是合金制品 |
某物质A在一定条件下加热完全分解,产物都是气体,2A=3B+2C+2D.测得生成的混合气体对氢气的相对密度为11.43,则A的相对分子质量( )
| A、11.43 |
| B、22.86 |
| C、45.72 |
| D、80.01 |
把100mL的2mol/LNaOH溶液,100mL、2mol/L的H2SO4溶液以及一定量的氨水混合,所得的溶液使酚酞试液显浅红色,则溶液中离子浓度关系正确的是( )
| A、C(SO42-)=C(Na+)>C(NH4+)>C(OH-)>C(H+) |
| B、C(Na+)>C(SO42-)>C(NH4+)>C(OH-)>C(H+) |
| C、C(NH4+)>C(SO42-)=C(Na+)>C(OH-)>C(H+) |
| D、C(H+)+C(NH4+)+C(Na+)=C(OH-)+C(SO42-) |
在4℃时下列溶液一定呈酸性的是( )
| A、pH=7的溶液 |
| B、遇酚酞显无色的溶液 |
| C、含有H+的溶液 |
| D、溶液中由水电离出的C(OH-)=10-9 mol?L-1 |
下列叙述正确的是( )
| A、Li在氧气中燃烧只生成Li2O |
| B、将SO2通入过量BaCl2溶液可生成BaSO3沉淀 |
| C、将稀硫酸滴加到Fe(NO3)2溶液中无明显现象 |
| D、新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
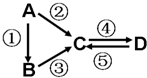 A、B、C、D均为常见的纯净物,A是单质.它们之间有如下的反应关系:
A、B、C、D均为常见的纯净物,A是单质.它们之间有如下的反应关系: