题目内容
16.现有下列八种物质:①NaOH溶液 ②铁丝 ③液态HC1④熔融氯化钠 ⑤硫酸钠固体⑥CO2 ⑦酒精⑧生石灰.(1)上述物质中,可导电的是①②④(填序号,下同).
(2)上述物质中,属于非电解质的是⑥⑦.
(3)上述物质中,属于电解质但不导电的是③⑤⑧.
分析 存在自由移动的带电微粒即可导电;在水溶液中或熔化状态下能导电的化合物属于电解质;在水溶液中和熔化状态下都不能导电的化合物属于非电解质.
解答 解:①NaOH溶液,能导电,属于混合物,既不是电解质也不是非电解质;
②铁丝能导电,属于金属单质,既不是电解质也不是非电解质;
③液态HCl不能导电,溶于水能导电,属于电解质;
④熔融氯化钠,电离出自由移动的离子能导电属于电解质;
⑤硫酸钠固体不能导电,溶于水或熔融状态下能导电,属于电解质;
⑥CO2本身不能电离,属于非电解质,其水溶液能导电的原因是二氧化碳溶于谁生成的碳酸导电;
⑦酒精不能导电,属于非电解质;
⑧生石灰不能导电,溶于水形成电解质导电或熔融状态下能导电,属于电解质;
(1)上述物质中,可导电的是①②④,故答案为:①②④;
(2)上述物质中,属于非电解质的是⑥⑦,
故答案为:⑥⑦;
(3)上述物质中,属于电解质但不导电的是③⑤⑧,
故答案为:③⑤⑧.
点评 本题考查电解质与非电解质,明确电解质与非电解质都属于化合物及导电的原因即可解答,题目难度不大.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
7.下式表示一种有机物的结构,关于它的性质叙述中不正确的是( )


| A. | 它能与纯碱溶液反应 | |
| B. | 它可以水解,水解生成的有机产物有二种 | |
| C. | 1 mol该有机物最多能和8 mol NaOH反应 | |
| D. | 该有机物能发生取代反应 |
4.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液.下列对此现象说法正确的是( )
| A. | 沉淀溶解后,将会生成深蓝色的配合离子[Cu(NH3)4]2+ | |
| B. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 | |
| C. | 向反应后的溶液加入乙醇,溶液不会有变化,因为[Cu(NH3)4]2+不会与乙醇发生反应 | |
| D. | 在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道 |
11.在容积相同的①、②、③三个烧瓶中分别充满NH3、HCl和NO2气体,当把烧瓶倒扣到水中且水与气体充分反应后,所得溶液的物质的量浓度的关系是( )
| A. | ①=②=③ | B. | ①>②>③ | C. | ①=②>③ | D. | ①=②<③ |
1.下述根据下列操作现象或事实,所得结论正确的是( )
| 实验操作及现象 | 实验结论 | |
| A | 分别向2mL 0.1mol•L-1 CH3COOH溶液和2mL 0.1mol•L-1 H3BO3溶液中滴加等浓度的NaHCO3溶液,前者有气泡产生,后者无明显现象 | 酸性:CH3COOH>H2CO3>H3BO3 |
| B | 向2mL 0.1mol•L-1 NaOH溶液中滴加3滴0.1mol•L-1 MgCl2溶液,出现白色沉淀后,再滴加3滴0.1mol•L-1 FeCl3溶液,出现红褐色沉淀 | 溶解度:Mg(OH)2>Fe(OH)3 |
| C | 过氧化钠用于呼吸面具中作为氧气的来源 | 过氧化钠是强氧化剂,能氧化二氧化碳 |
| D | 向含有淀粉的FeI2溶液中滴加足量的氯水后变蓝 | 还原性:I->Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
8.化学与人类生活、社会可持续发展密切相关.下列有关叙述中不正确的是( )
| A. | 回收废弃塑料制成燃油来替代汽油、柴油,可减轻环境污染和节约化石能源 | |
| B. | 火药是我国古代四大发明之一,配方为“一硫二硝三木炭”,其中的“硝”是指硝酸 | |
| C. | 高压钠灯发出的黄光射程远、透雾能力强,常用作路灯 | |
| D. | 黑色金属材料通常包括铁、铬、锰以及它们的合金,是应用非常广泛的金属材料 |
5.化学基本概念及原理在化学反应中应用广泛.
(1)甲醇是重要的化工原料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,反应如下:
①CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1 K1
②CO2(g)+H2(g)?CO(g)+H2O(g)△H2 K2
③CO(g)+2H2(g)?CH3OH(g)△H3 K3
已知相关的化学键键能(E)数据如表:
已知△H2=+41kJ•mol-1,则△H3=-220kJ•mol-1;平衡常数K3=$\frac{{K}_{1}}{{K}_{2}}$(用K1、K2表示).
(2)NaAlH4是重要的还原剂和储氢材料.可由甲合成NaAlH4,加热7.20g甲至完全分解,得到金属钠和3.36L(标准状况)的H2.
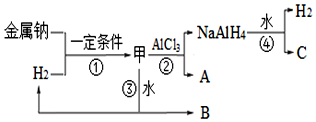
①A的电子式为Na+[:H]-;反应③的化学方程式为NaH+H2O=H2↑+NaOH.
②NaAlH4在催化剂作用下释放氢时生成Na3AlH6和两种单质,则该反应的化学方程式为3NaAlH4=Na3AlH6+3H2↑+2Al.
③为制备甲并检验其是否纯净,某同学设计方案:用惰性气体赶尽反应体系中的空气,将锌和稀硫酸反应后的气体经浓硫酸干燥,再与金属钠反应,得到固体物质;取该固体物质与水反应,产生H2,证明固体物质一定是纯净的.该同学设计的方案是否合理并说明理由不合理,Na和NaH都能与水反应生成H2.
(1)甲醇是重要的化工原料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,反应如下:
①CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1 K1
②CO2(g)+H2(g)?CO(g)+H2O(g)△H2 K2
③CO(g)+2H2(g)?CH3OH(g)△H3 K3
已知相关的化学键键能(E)数据如表:
| 化学键 | H-H | C-O | C=O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 745 | 465 | 413 |
(2)NaAlH4是重要的还原剂和储氢材料.可由甲合成NaAlH4,加热7.20g甲至完全分解,得到金属钠和3.36L(标准状况)的H2.

①A的电子式为Na+[:H]-;反应③的化学方程式为NaH+H2O=H2↑+NaOH.
②NaAlH4在催化剂作用下释放氢时生成Na3AlH6和两种单质,则该反应的化学方程式为3NaAlH4=Na3AlH6+3H2↑+2Al.
③为制备甲并检验其是否纯净,某同学设计方案:用惰性气体赶尽反应体系中的空气,将锌和稀硫酸反应后的气体经浓硫酸干燥,再与金属钠反应,得到固体物质;取该固体物质与水反应,产生H2,证明固体物质一定是纯净的.该同学设计的方案是否合理并说明理由不合理,Na和NaH都能与水反应生成H2.
6.下列关于有机化合物的说法不正确的是( )
| A. | 1,2-二甲苯也称邻二甲苯 | |
| B. | 氨基乙酸与a-氨基丙酸的混合物一定条件下脱水能生成4种二肽 | |
| C. | 苯与溴水不能发生加成反应,所以两者混合后无明显现象 | |
| D. | C5H10O2属于羧酸的同分异构体有4种 |