题目内容
用11.5g金属钠放入水中,要使100个水分子溶有1个钠离子,则
(1)写出反应的离子方程式,并用单线桥法标出电子转移的方向和数目.
(2)生成标准状况下的H2体积是多少升?
(3)需加水多少克?
(1)写出反应的离子方程式,并用单线桥法标出电子转移的方向和数目.
(2)生成标准状况下的H2体积是多少升?
(3)需加水多少克?
考点:钠的化学性质,化学方程式的有关计算
专题:计算题,几种重要的金属及其化合物
分析:(1)根据钠与水反应生成氢氧化钠和氢气的方程式中元素的化合价的变化,化合价升高的钠元素的原子失去电子,化合价降低的氢元素的原子得到电子,得失电子数目相等,用线桥法标出电子转移的方向和数目即可;
(2)根据钠与水反应生成氢氧化钠和氢气的方程式进行计算;
(3)利用n=
计算Na的物质的量,由Na原子守恒可知,n(Na)=n(Na+),再利用100个水分子中溶有1个钠离子来列式计算出水的物质的量及其质量;
(2)根据钠与水反应生成氢氧化钠和氢气的方程式进行计算;
(3)利用n=
| m |
| M |
解答:
解:(1)钠与水反应生成氢氧化钠和氢气2Na+2H2O═2NaOH+H2↑,其离子反应为2Na+2H20═2Na++2OH-+H2↑,该反应中钠失去电子0→+1,氢得到电子+1→0,转移2e-,
则单线桥标出电子转移的方向和数目为 ,
,
故答案为:2Na+2H20═2Na++2OH-+H2↑; ;
;
(2)n(Na)=n(Na+)=
=0.5mol,设能生成氢气在标况下的体积为V,
2Na+2H2O=2NaOH+H2↑
2mol 22.4L
0.5mol 2mol V
=
,V=5.6L,
故答案为:5.6L;
(3)n(Na)=n(Na+)=
=0.5mol,设水的物质的量为x,2Na+2H2O=2NaOH+H2↑,反应消耗的水的物质的量为0.5mol,质量为9g,由100个水分子中溶有1个钠离子,则
=
,解得x=50.5mol,水的质量为50.5mol×18g/mol=909g,
故答案为:909g;
则单线桥标出电子转移的方向和数目为
 ,
,故答案为:2Na+2H20═2Na++2OH-+H2↑;
 ;
;(2)n(Na)=n(Na+)=
| 11.5g |
| 23g/mol |
2Na+2H2O=2NaOH+H2↑
2mol 22.4L
0.5mol 2mol V
| 2mol |
| 0.5mol |
| 22.4L |
| V |
故答案为:5.6L;
(3)n(Na)=n(Na+)=
| 11.5g |
| 23g/mol |
| 100 |
| 1 |
| x-0.5 |
| 0.5 |
故答案为:909g;
点评:本题考查有关物质的量的计算,明确质量、物质的量的关系及信息中水分子与钠离子的关系为解答关键,题目难度中等.

练习册系列答案
相关题目
下列说法中正确的是( )
| A、硫酸的摩尔质量是98g |
| B、2mol水的质量是18g/mol |
| C、氯化氢的摩尔质量等于它的相对分子质量 |
| D、22g二氧化碳的物质的量是0.5mol |
在下列溶液中Cl-离子的物质的量浓度最大的是( )
| A、0.5L 0.1mol/L的NaCl溶液 |
| B、100mL 0.2mol/L的MgCl2溶液 |
| C、50mL 0.2mol/L的AlCl3溶液 |
| D、1L 0.5mol/L盐酸溶液 |
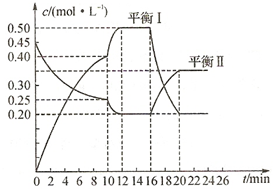 向一容积不变的密闭容器中充入一定量A和B,发生如下反应:
向一容积不变的密闭容器中充入一定量A和B,发生如下反应: