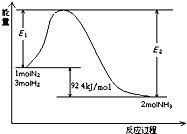
题目内容
向Fe3O4和 Fe的固体混合物6.88g中 加入50ml 2 mol?L-1H2SO4,恰好使固体完全溶解,并放出一定量气体. 在所得溶液中加入KSCN溶液,溶液不变红色.
(1)写出Fe3O4和稀H2SO4反应的化学方程式 .
(2)混合物中Fe3O4和 Fe的物质的量(写出计算过程).
(3)求反应中产生的气体在标准状况下的体积.(写出计算过程).
(4)若用足量的CO在高温下与相同质量的上述固体混合物反应,求最终能得到铁的质量.(写出计算过程).
(1)写出Fe3O4和稀H2SO4反应的化学方程式
(2)混合物中Fe3O4和 Fe的物质的量(写出计算过程).
(3)求反应中产生的气体在标准状况下的体积.(写出计算过程).
(4)若用足量的CO在高温下与相同质量的上述固体混合物反应,求最终能得到铁的质量.(写出计算过程).
考点:化学方程式的有关计算,有关混合物反应的计算
专题:计算题
分析:向Fe3O4和 Fe的固体混合物6.88g中 加入50ml 2 mol?L-1H2SO4,恰好完全反应,所得溶液中加入KSCN溶液,无血红色出现,说明溶液中的溶质为FeSO4,发生反应:Fe+2H+=Fe2++H2↑、Fe3O4+8H+=Fe2++2Fe3++4H2O、Fe+2Fe3+=3Fe2+,设原混合物中Fe和Fe3O4的物质的量分别为xmol、ymol,根据混合物的质量和消耗的硫酸的物质的量,结合Fe元素守恒,联立方程计算解答.
解答:
解:(1)Fe3O4和稀H2SO4反应的生成硫酸亚铁和硫酸铁、水,其反应的化学方程式为Fe3O4+4H2SO4=FeSO4+Fe2(SO4)3+4H2O;
故答案为:Fe3O4+4H2SO4=FeSO4+Fe2(SO4)3+4H2O;
(2)设原混合物中Fe和Fe3O4的物质的量分别为xmol、ymol
混合物与H2SO4恰好完全反应,所得溶液中加入KSCN溶液,无血红色出现,说明溶液中的溶质为FeSO4,
则n(Fe2+)=n(H2SO4)=0.05L×2 mol?L-1=0.1mol,
由Fe元素守恒得:x+3y=0.1mol;
56x+232y=6.88g,
解得:x=0.04mol,y=0.02mol,
答:混合物中Fe3O4和 Fe的物质的量分别为0.02mol、0.04mol;
(3)Fe3O4+8H+=Fe2++2Fe3++4H2O、
0.02 0.04mol
Fe+2Fe3+=3Fe2+,
0.02mol 0.04mol
Fe+2H+=Fe2++H2↑,
0.02mol 0.02mol
则V(H2)=0.02mol×22.4L/mol=0.448L,
答:产生的气体在标准状况下的体积为0.448L;
(4)n(Fe2+)=n(H2SO4)=0.05L×2 mol?L-1=0.1mol,则Fe3O4和 Fe的固体混合物中Fe元素共0.1mol,
足量的CO在高温下与相同质量的上述固体混合物反应,最终能得到铁的质量为0.1mol,其质量为0.1mol×56g/mol=5.6g,
答:最终能得到铁的质量为5.6g.
故答案为:Fe3O4+4H2SO4=FeSO4+Fe2(SO4)3+4H2O;
(2)设原混合物中Fe和Fe3O4的物质的量分别为xmol、ymol
混合物与H2SO4恰好完全反应,所得溶液中加入KSCN溶液,无血红色出现,说明溶液中的溶质为FeSO4,
则n(Fe2+)=n(H2SO4)=0.05L×2 mol?L-1=0.1mol,
由Fe元素守恒得:x+3y=0.1mol;
56x+232y=6.88g,
解得:x=0.04mol,y=0.02mol,
答:混合物中Fe3O4和 Fe的物质的量分别为0.02mol、0.04mol;
(3)Fe3O4+8H+=Fe2++2Fe3++4H2O、
0.02 0.04mol
Fe+2Fe3+=3Fe2+,
0.02mol 0.04mol
Fe+2H+=Fe2++H2↑,
0.02mol 0.02mol
则V(H2)=0.02mol×22.4L/mol=0.448L,
答:产生的气体在标准状况下的体积为0.448L;
(4)n(Fe2+)=n(H2SO4)=0.05L×2 mol?L-1=0.1mol,则Fe3O4和 Fe的固体混合物中Fe元素共0.1mol,
足量的CO在高温下与相同质量的上述固体混合物反应,最终能得到铁的质量为0.1mol,其质量为0.1mol×56g/mol=5.6g,
答:最终能得到铁的质量为5.6g.
点评:本题考查混合物的计算,题目难度中等,利用元素守恒判断铁的物质的量是解题关键,注意守恒思想的运用和三价铁离子的检验方法.

练习册系列答案
 每课必练系列答案
每课必练系列答案
相关题目
下列化学用语错误的是( )
A、Na+的结构示意图: |
B、水分子的电子式: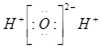 |
| C、二氧化碳的结构式:O=C=O |
| D、硫酸钠的电离方程式:Na2SO4=2Na++SO42- |
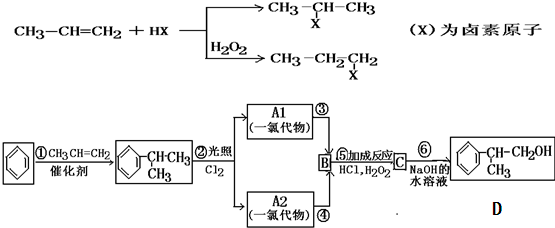
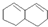 在较高温度下和Br2按物质的量之比1:1发生加成反应的方程
在较高温度下和Br2按物质的量之比1:1发生加成反应的方程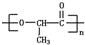 是由一种单体缩聚而成的,该单体的结构简式为
是由一种单体缩聚而成的,该单体的结构简式为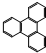 的一氯取代物有
的一氯取代物有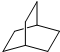 的二氯取代物有
的二氯取代物有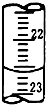 实验室中有一未知浓度的稀盐酸,某学生在实验室中进行测定盐酸浓度的实验,请完成下列填空:
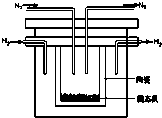
实验室中有一未知浓度的稀盐酸,某学生在实验室中进行测定盐酸浓度的实验,请完成下列填空: 如图所示,若电解5min时铜电极质量增加2.16g,试回答:
如图所示,若电解5min时铜电极质量增加2.16g,试回答: