题目内容
下列化学用语错误的是( )
A、Na+的结构示意图: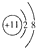 |
B、水分子的电子式: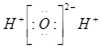 |
| C、二氧化碳的结构式:O=C=O |
| D、硫酸钠的电离方程式:Na2SO4=2Na++SO42- |
考点:原子结构示意图,电子式,结构式
专题:化学用语专题
分析:A、Na+的质子数为11,核外电子数为10,有2个电子层,最外层电子数为8;
B、水中存在两个氧氢键,氧原子最外层达到8电子稳定结构,水的电子式为 ;
;
C、二氧化碳分子中碳原子与氧原子之间形成2对共用电子对;
D、先判断电解质的强弱,强电解质用“═”,电离方程式应遵循质量守恒定律和电荷守恒,并注意原子团不可拆分来解答.
B、水中存在两个氧氢键,氧原子最外层达到8电子稳定结构,水的电子式为
 ;
;C、二氧化碳分子中碳原子与氧原子之间形成2对共用电子对;
D、先判断电解质的强弱,强电解质用“═”,电离方程式应遵循质量守恒定律和电荷守恒,并注意原子团不可拆分来解答.
解答:
解:A、Na+的质子数为11,核外电子数为10,有2个电子层,最外层电子数为8,结构示意图为 ,故A正确;
,故A正确;
B、水中存在两个氧氢键,氧原子最外层达到8电子稳定结构,水的电子式为: ,故B错误;
,故B错误;
C、二氧化碳分子中碳原子与氧原子之间形成2对共用电子对,存在碳氧双键,结构式为O═C═O,故C正确;
D、Na2SO4为强电解质,电离方程式为Na2SO4=2Na++SO42-,遵循质量守恒定律和电荷守恒,故D正确;
故选C.
 ,故A正确;
,故A正确; B、水中存在两个氧氢键,氧原子最外层达到8电子稳定结构,水的电子式为:
 ,故B错误;
,故B错误;C、二氧化碳分子中碳原子与氧原子之间形成2对共用电子对,存在碳氧双键,结构式为O═C═O,故C正确;
D、Na2SO4为强电解质,电离方程式为Na2SO4=2Na++SO42-,遵循质量守恒定律和电荷守恒,故D正确;
故选C.
点评:本题考查原子结构示意图、电离方程式、结构简式和电子式,题目难度不大,注意碳碳双键在结构简式中不能省略.

练习册系列答案
相关题目
在H2SO4、Fe2(SO4)3和CuSO4的混合溶液中,投入一定量的铁屑,充分反应后,发现铁屑有剩余,溶液中存在的阳离子有( )
| A、只有Fe2+ |
| B、有Fe2+和Fe3+ |
| C、有Cu2+和Fe2+ |
| D、有H+和Fe3+ |
下列离子方程式中书写正确的是( )
| A、FeCl2溶液中通入Cl2 Fe2++Cl2═Fe3++2Cl- |
| B、Al2O3与NaOH溶液反应 Al2O3+2OH-═2AlO2-+H2O |
| C、FeCl3溶液与铜 Fe3++Cu═Fe2++Cu2+ |
| D、用醋酸除水垢 2CH3COOH+CaCO3═2CH3COO-+Ca2++H2O+CO2 |
下列物质属于不属于混合物的是( )
| A、纯碱 | B、石油 | C、煤 | D、碱石灰 |

