题目内容
20.化学与生活、生产密切相关.下列叙述不正确的是( )| A. | “血液透析”利用了胶体的性质 | |
| B. | 铜盐溶液都有毒,Cu2+能使蛋白质变性 | |
| C. | 硅酸钠的水溶液俗称水玻璃,是制备硅胶和木材防火剂等的原料 | |
| D. | 漂白液的有效成分为CaCl2和Ca(ClO)2 |
分析 A、血液是胶体;
B、铜盐为重金属盐;
C、硅酸钠能和强酸反应制取硅胶;
D、漂白液是氯气和氢氧化钠反应制取的.
解答 解:A、血液是胶体,能发生渗析,血液透析既是利用了此性质,故A正确;
B、铜盐为重金属盐,能使蛋白质变性,故对人体有毒,故B正确;
C、硅酸钠能和强酸反应制取硅胶,其水溶液俗称水玻璃,能用作木材防火剂,故C正确;
D、漂白液是氯气和氢氧化钠反应制取的,主要成分为氯化钠和次氯酸钠,有效成分为次氯酸钠,故D错误.
故选D.
点评 本题考查了胶体的性质、蛋白质的变性以及漂白液的成分等,难度不大,注意基础的掌握.

练习册系列答案
相关题目
18.下图各容器中均盛有稀盐酸,能形成原电池且铁为正极的是( )
| A. |  | B. |  | C. |  | D. |  |
19.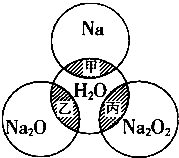 如图所示,两圆圈相交的阴影部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )
如图所示,两圆圈相交的阴影部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )
 如图所示,两圆圈相交的阴影部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )
如图所示,两圆圈相交的阴影部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )| A. | 甲、乙、丙都属于氧化还原反应 | |
| B. | 甲反应的离子方程式为Na+2H2O═Na++2OH-+H2↑ | |
| C. | 丙完全反应,能产生0.05molO2,转移电子0.1mol | |
| D. | 甲、乙、丙充分反应后所得溶液的质量分数分别为w1、w2、w3,则2w1=w2=w3 |
15.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1mol/L NaOH 溶液:K+,Na+,SO42-,CO32- | |
| B. | 0.1mol/L Na2CO3溶液:K+,Ba2+,NO3-,Cl- | |
| C. | 0.1mol/L FeCl3溶液:K+、H+,I-,SCN- | |
| D. | pH=1的溶液中:K+、Fe2+、Cl-、NO3- |
5.生活中的一些问题常涉及到化学知识,下列叙述正确的是( )
| A. | 晶体硅具有半导体的性质,所以可以制作光导纤维 | |
| B. | 氯化铁溶液可用于制作印刷电路板是因为其具有氧化性,与铜发生置换反应 | |
| C. | 明矾和漂白粉常用于自来水的处理,两者的作用原理相同 | |
| D. | 水泥厂和冶金厂常用高压直流电除去大量烟尘,减少对空气的污染 |
9.设NA表示阿伏加德罗常数.下列说法中,不正确的是( )
| A. | 标准状况下,22.4 L氢气和氧气的混合气体,所含分子数为NA | |
| B. | 常温常压下,1 mol氦气含有的原子数为2NA | |
| C. | 1 mol Al3+含有核外电子数为10NA | |
| D. | 1 L 1 mol/L FeCl3溶液中Cl-的数目等于3NA |
