题目内容
18.下图各容器中均盛有稀盐酸,能形成原电池且铁为正极的是( )| A. |  | B. |  | C. |  | D. |  |
分析 盐酸为电解质溶液,Fe为正极,各装置中另一种为负极,另一种金属的活泼性比铁强,还必须形成闭合回路,据此进行解答.
解答 解:A.该装置中Al的活泼性大于Fe,铝为负极,Fe为正极,满足条件,故A正确;
B.该装置形成了原电池,铁为负极,不满足条件,故B错误;
C.该原电池中铁为负极,不满足条件,故C错误;
D.该装置没有形成闭合回路,没有构成原电池,故D错误;
故选A.
点评 本题考查了原电池原理,题目难度不大,明确原电池构成条件为解答关键,注意掌握原电池两极的判断方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
9.解释下列操作或事实的离子方程式正确的是( )
| A. | 把钠投入水中:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2═I2+2H2O | |
| C. | 碳酸氢钠与稀硫酸反应:CO32-+2H+═H2O+CO2↑ | |
| D. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
6.如图为铜锌原电池示意图,按该装置进行实验.下列说法正确的是( )
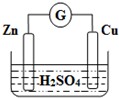

| A. | Zn是负极,Cu是正极 | B. | 稀硫酸溶液中H+移向Zn极 | ||
| C. | 电子由铜片通过导线流向锌片 | D. | 该装置能将电能转变为化学能 |
13.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 1mol Cl2参加反应转移电子数一定为2NA | |
| B. | 常温常压下,NA个CH4分子占有的体积约为22.4L | |
| C. | 常温常压下,1mol Na2O2中阴离子为2NA个 | |
| D. | 标准状况下,11.2L16O2和11.2L18O2均含有NA个氧原子 |
3.在l℃时,10mL0.4mol•L-1H2O2溶液发生催化分解:2H2O2 $\frac{\underline{\;催化剂\;}}{\;}$ 2H2O+O2↑,不同时刻测得生成O2的体积(已折算为标准状况)如下表:
下列叙述不正确的是(溶液体积变化忽略不计)( )
| t/min | 0 | 2 | 4 | 6 |
| V( 02 )/mL | 0.0 | 9.9 | 17.2 | 22.4 |
| A. | 0-2min的平均反应速率比4-6min快 | |
| B. | 0-6min 的平均反应速率v( H2O2)=3.3 x 10-2 moL-1•min-1 | |
| C. | 反应至 6min 时,c( H2O2)=0.3mol•L-1 | |
| D. | 反应至6min时,H2O2分解了 50% |
10.下列物质的水溶液因水解而显酸性的是( )
| A. | KNO3 | B. | Fe2(SO4)3 | C. | Na2CO3 | D. | H2SO4 |
7.设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 4.6 g乙醇中含有的C-H键的个数为0.6NA | |
| B. | 34 gH2O2中含有的阴离子数为NA | |
| C. | 标准状况下,11.2 LCHCl3中含有的分子数为0.5NA | |
| D. | 9.2gNO2和N2O4混合气体中含有的原子总数为0.6NA |
20.化学与生活、生产密切相关.下列叙述不正确的是( )
| A. | “血液透析”利用了胶体的性质 | |
| B. | 铜盐溶液都有毒,Cu2+能使蛋白质变性 | |
| C. | 硅酸钠的水溶液俗称水玻璃,是制备硅胶和木材防火剂等的原料 | |
| D. | 漂白液的有效成分为CaCl2和Ca(ClO)2 |