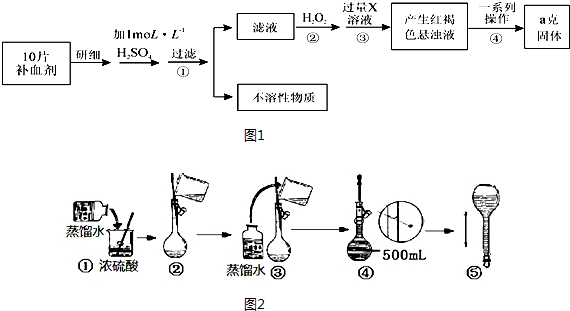
题目内容
11.有三种金属单质A、B、C,其中单质A的焰色反应为黄色,B、C是常见金属.三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如图转化关系(图中有些反应的产物和反应的条件没有全部标出).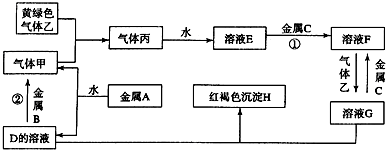
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:
ANa、HFe(OH)3、GFeCl3、乙Cl2
(2)写出下列反应的化学方程式
反应①Fe+2HCl═FeCl2+H2↑.
反应②2NaOH+2Al+2H2O═2NaAlO2+3H2↑.
分析 框图推断题要注意寻找解题的突破口,金属A焰色反应为黄色,故A为金属Na,与水反应生成NaOH与氢气,则D为NaOH,气体甲为H2;氢氧化钠与金属B反应生成氢气,故金属B为Al.黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸.氢氧化钠与物质G反应生成红褐色沉淀H是Fe(OH)3,故物质G中含有Fe3+,由转化关系HCl$\stackrel{金属C}{→}$物质F$\stackrel{氯气}{→}$物质G,可知金属C为Fe,物质F为FeCl2,物质G为FeCl3,结合物质的性质解答该题.
解答 解:金属A焰色反应为黄色,故A为金属Na,与水反应生成NaOH与氢气,则D为NaOH,气体甲为H2;氢氧化钠与金属B反应生成氢气,故金属B为Al.黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸.氢氧化钠与物质G反应生成红褐色沉淀H是Fe(OH)3,故物质G中含有Fe3+,由转化关系HCl$\stackrel{金属C}{→}$物质F$\stackrel{氯气}{→}$物质G,可知金属C为Fe,物质F为FeCl2,物质G为FeCl3,
(1)A的焰色反应为黄色,所以A一定是金属钠,钠和水反应生成氢气和氢氧化钠,甲是氢气,D的溶液是氢氧化钠,气体并是氯化氢,所以E是盐酸,红褐色的沉淀H一定是氢氧化铁,所以金属C是铁,F是氯化亚铁,能和氢氧化钠反应生成氢气的金属只有铝,所以B是铝.
故答案为:Na;Fe(OH)3;FeCl3;Cl2;
(2)铁和盐酸的反应为:Fe+2HCl═FeCl2+H2↑,氢氧化钠能和铝反应,方程式为:2NaOH+2Al+2H2O═2NaAlO2+3H2↑,
故答案为:Fe+2HCl═FeCl2+H2↑;2NaOH+2Al+2H2O═2NaAlO2+3H2↑.
点评 本题是考查物质推断与性质、常用化学用语,涉及Na、Fe、Al元素单质化合物的性质及相互转化,注意特殊的颜色与特殊反应是推断的突破口,难度中等,掌握元素化合物的性质是解题的关键,需要学生熟练掌握元素化合物知识.

| A. | 在多电子的原子里,能量高的电子通常在离核近的区域内活动 | |
| B. | 核外电子总是先排在能量低的电子层上,例如只有排满了L层后才排M层 | |
| C. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 | |
| D. | 微粒的最外层只能是8个电子才稳定 |
| A. | 在周期表中,元素的族序数都等于其原子的最外层电子数 | |
| B. | 周期表中非金属性最强的元素,其最高价氧化物的水化物酸性也最强 | |
| C. | 同主族元素随原子核电荷数的递增,原子半径依次减小 | |
| D. | ⅦA族元素的单质,随分子量的增大,熔、沸点升高;ⅠA族单质,随分子量的增大,熔、沸点降低 |
| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 组成元素 | B、C | A、C | A、D | C、D |
(1)丙物质的化学式为NaH,丁物质中阴离子与阳离子的个数之比为1:2.
(2)若标准状况下5.6L甲物质完全燃烧放出的热量为akJ,试写出表示甲物质燃烧热的热化学方程式CO(g)+$\frac{1}{2}$O2(g)=CO2 (g);△H=-4a kJ/mol.
(3)研究表明乙物质具有弱酸性,则乙物质在水中的电离方程式为H2O2?H++HO2-.
(4)某同学设计了一个以结构简式是BA3-CA的物质为燃料的电池,并用该电池电解200mL一定浓度的NaCl与CuSO4的混合溶液,其装置如图1:

①写出ⅰ中通入该物质这一极的电极反应式CH3OH-6e-+8OH-=CO32-+6H2O.
②理论上ⅱ中两极所得气体的体积随时间变化的关系如坐标图2所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式2 H2O-4e-=O2↑+4 H+;在t2时所得溶液的pH约为1.
请回答下列问题:
(1)划分下列能源的类别,把序号填入相应的表格
①石油 ②地热能 ③沼气 ④风能 ⑤可燃冰
| 类别 | 编号 |
| 新能源 | |
| 常规能源 |
①利用潮汐能发电 ②推广使用乙醇汽油
③用家用汽车代并公交车 ④用节能灯代替白炽灯.
| A. | 加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉 | |
| B. | 用分液的方法分离汽油和煤油 | |
| C. | 用溶解、过滤的方法分离KNO3和NaCl固体混合物 | |
| D. | 将O2和H2的混合气体通过灼热的氧化铜,以除去其中的H2 |
| 时间/浓度 | c(NH3)(mol/L) | c(O2 )(mol/L) | c(NO)(mol/L) |
| 起始 | 0.800 | 1.000 | 0.000 |
| 第2min | a | b | c |
| 第4min | 0.400 | 0.500 |
A.容器中气体平均摩尔质量不变
B.c(O2)不变
C.v(O2)=1.25v(NH3)
D.体系气体无颜色变化
E.体系压强不变
(2)在容器中加入正催化剂,则反应速率增大(填“增大”“减小”“不变”;后同),降低容器的温度则反应速率减小.
(3)反应在第2min时,容器中压强与反应前之比为19:18,则a=mol/L;0~2min平均速率v(NH3)=0.2mol/(L•min).第4min时反应是(是、否)达到平衡
(4)如果把该反应设计为原电池,NH3在原电池负极,电解质溶液中阴离子向负极移动.若果以NaCl为电解质,正极反应为:O2+2H2O+4e-=4OH-.
| A. | FeSO4酸性溶液暴露在空气中:2Fe2++O2+4H+=2Fe3++2H2O | |
| B. | MgSO4溶液滴入到Ba(OH)2溶液中:SO42-+Ba2+=BaSO4↓ | |
| C. | 向NaAlO2溶液中通入足量CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- | |
| D. | FeCl3溶液中加入少量NaHS溶液:Fe3++3HS-+3H2O=Fe(OH)3↓+3H2S↑ |