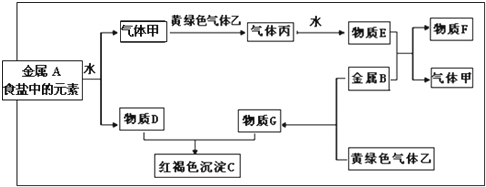
题目内容
4.按要求写出下列物质或官能团的名称:(1)
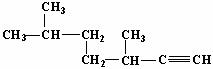 的名称为3,6-二甲基-1-庚炔;
的名称为3,6-二甲基-1-庚炔;(2)
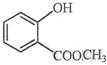 中含氧官能团的名称为羟基、酯基.
中含氧官能团的名称为羟基、酯基.
分析 (1)烯烃的命名:选择含有双键的最长碳链为主链,从离双键最近的一端开始编号,其余的和烷烃的命名相似.
(2) 中的含氧官能团为羟基、酯基.
中的含氧官能团为羟基、酯基.
解答 解:(1)此物质中含碳碳三键的最长碳链含有7个碳原子,命名为庚炔,从离官能团近的一端给主链上的碳原子进行编号,则碳碳三键在1号额2号碳原子之间,用编号较小的碳原子表示出三键的位置,在3号和6号碳原子上各有1个甲基,故命名为:3,6-二甲基-1-庚炔,故答案为:3,6-二甲基-1-庚;
(2) 中的含氧官能团为羟基、酯基,故答案为:羟基;酯基.
中的含氧官能团为羟基、酯基,故答案为:羟基;酯基.
点评 本题考查有机物的结构及命名,难度不大,注意把握常见的官能团的名称.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.已知反应X+Y=M+N为吸热反应,对这个反应的下列说法中正确的是( )
| A. | X的能量一定低于M的,Y的能量一定低于N的 | |
| B. | 因为该反应为吸热反应,故一定要加热反应才能进行 | |
| C. | 破坏反应物中的化学键所吸收的能量大于形成生成物中化学键所放出的能量 | |
| D. | 增加X的物质的量,该反应的化学反应速率一定加快 |
12.下列实验事实陈述ⅠⅡ正确并且有因果关系的是( )
| Ⅰ操作 | Ⅱ结论 | |
| A | 滴加BaC12溶液生成白色沉淀 | 原溶液中有SO42- |
| B | 用洁净铂丝蘸取溶液进行焰色反应:火焰呈黄色 | 原溶液中有Na+无K+ |
| C | 滴加几滴稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝 | 原溶液中无NH4+ |
| D | 滴加氯水和CC14,振荡、静置.下层溶液显紫色 | 原溶液中有I- |
| A. | A | B. | B | C. | C | D. | D |
19.日常所用锌-锰干电池的电极分别为锌筒和石墨棒,以糊状NH4Cl作电解质,电极反应为:Zn-2e-=Zn2+,2MnO2+2NH4++2e-=Mn2O3+2NH3+H2O.下列有关锌-锰干电池的叙述中,正确的是( )
| A. | 干电池中锌筒为正极,石墨棒为负极 | |
| B. | 干电池长时间连续工作后,糊状物可能流出,腐蚀用电器 | |
| C. | 干电池工作时,电流方向是由锌筒经外电路流向石墨棒 | |
| D. | 干电池可实现化学能向电能和电能向化学能的相互转化 |
16.化学反应是旧化学键断裂和新化学键形成的过程.氢气与氧气的反应中,破坏lmol氢氢键消耗的能量为Q1kJ、破坏1mol氧氧键消耗的能量为Q2kJ、形成lmol氢氧键释放的能量为Q3kJ.下列关系中正确的是( )
| A. | Ql+Q2<Q3 | B. | Ql+Q2>2Q3 | C. | 2Ql+Q2<4Q3 | D. | 2Ql+Q2>4Q3 |
14. 某探究小组用HNO3与大理石反应过程中质量减小的方法研究影响反应速率的因素.所用HNO3浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3用量为25.0mL,大理石用量为10.00g.
某探究小组用HNO3与大理石反应过程中质量减小的方法研究影响反应速率的因素.所用HNO3浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3用量为25.0mL,大理石用量为10.00g.
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
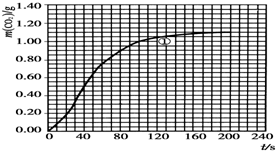
(2)实验①中CO2质量随时间变化的关系见图:
依据反应方程式$\frac{1}{2}$CaCO3+HNO3═$\frac{1}{2}$Ca(NO3)2+$\frac{1}{2}$CO2↑+$\frac{1}{2}$H2O,计算实验①在70~90s范围内HNO3的反应速率(忽略溶液体积变化,写出计算过程).
 某探究小组用HNO3与大理石反应过程中质量减小的方法研究影响反应速率的因素.所用HNO3浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3用量为25.0mL,大理石用量为10.00g.
某探究小组用HNO3与大理石反应过程中质量减小的方法研究影响反应速率的因素.所用HNO3浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3用量为25.0mL,大理石用量为10.00g.(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol•L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3的浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究大理石规格 (粗、细)对该反应速率 的影响. |
| ② | ||||
| ③ | ||||
| ④ |
依据反应方程式$\frac{1}{2}$CaCO3+HNO3═$\frac{1}{2}$Ca(NO3)2+$\frac{1}{2}$CO2↑+$\frac{1}{2}$H2O,计算实验①在70~90s范围内HNO3的反应速率(忽略溶液体积变化,写出计算过程).
 如图所示为短周期的一部分,如果B原子和C原子的核外电子总数之和为A的4倍,则:
如图所示为短周期的一部分,如果B原子和C原子的核外电子总数之和为A的4倍,则: ,C的离子结构示意图:
,C的离子结构示意图:
 .
. ,工业合成路线如下:
,工业合成路线如下:

 (R-代表烃基)
(R-代表烃基) 、
、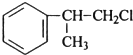 ;
;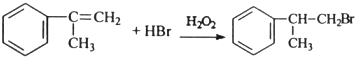 ;
; .
.