题目内容
9.为了探究Cl2、SO2同时通入H2O中发生的反应,某化学兴趣小组同学设计了图1所示的实验装置.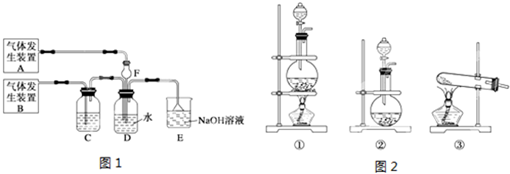
(1)该化学兴趣小组同学为制取Cl2和SO2气体,现采用Na2SO3与70%的浓硫酸为原料制取SO2,采用MnO2和浓盐酸(12mol/L)为原料制取Cl2.请写出制取Cl2的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O
(2)在此实验中,F仪器的作用是:防止倒吸;发生装置B应选择图2三种装置中的①(填序号).
(3)D装置中主要反应的离子方程式为Cl2+SO2+2H2O═4H++2Cl-+SO42-.
(4)为验证通入D装置中过量的气体是Cl2还是SO2气体,兴趣小组的同学准备了以下试剂:
①氯化铁溶液 ②氯化亚铁溶液 ③硫氰酸钾溶液④品红溶液 ⑤溴水 ⑥稀硝酸
A.若Cl2过量:取适量D中溶液滴加至盛有②③试剂的试管内,发生的现象是:溶液变为红色;(试剂可以多选,请填试剂的序号,下同).
B.若SO2过量:取适量D中溶液滴加至盛有④试剂的试管内,发生的现象是:红色褪去为无色,加热后又变为红色.
分析 (1)MnO2和浓盐酸混合加热生成氯化锰、水和氯气;
(2)气体容易与水反应,且溶解度较大会发生倒吸;根据反应原理来选择反应装置;
(3)D中是二氧化硫和氯气发生的氧化还原反应生成硫酸和盐酸,依据反应产物写出离子方程式;
(4)氯气过量可以设计实验验证氯气的氧化性,结合亚铁离子被氧化为铁离子后,加入硫氰酸钾溶液会变红色证明;二氧化硫过量可以依据二氧化硫具有漂白性设计实验和选择试剂验证.
解答 解:(1)MnO2和浓盐酸混合加热生成氯化锰、水和氯气,离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)SO2易与水反应,且溶解度较大会发生倒吸,则F可以防倒吸,装置B为制取氯气的装置,由固液反应且加热的原理可知应选择①,
故答案为:防止倒吸;①;
(3)D中是二氧化硫和氯气发生的氧化还原反应生成硫酸和盐酸,反应的离子方程式为:Cl2+SO2+2H2O═4H++2Cl-+SO42-,
故答案为:Cl2+SO2+2H2O═4H++2Cl-+SO42-;
(4)为验证通入D装置中的气体是Cl2还是SO2过量,若Cl2过量,取适量D中溶液滴加至盛有氯化亚铁溶液,试剂的试管内,再加入硫氰化钾溶液会变血红色,证明氯气氧氧化亚铁离子;若SO2过量,取适量D中溶液滴加至盛有品红溶液的试管中,红色褪去,加热又恢复红色,证明含有二氧化硫,
故答案为:②③;溶液变为红色;④;红色褪去为无色,加热后又变为红色.
点评 本题考查二氧化硫、氯气的性质,明确物质的性质及发生的化学反应是解答本题的关键,难度不大.

 如图是镁一空气燃料电池工作原理示惫图,电池总反应为:2Mg+O2+2H2O=2Mg(OH)2.下列有关该电池的说法正确的是( )
如图是镁一空气燃料电池工作原理示惫图,电池总反应为:2Mg+O2+2H2O=2Mg(OH)2.下列有关该电池的说法正确的是( )| A. | a极为负极,发生还原反应 | |
| B. | b电极上电极反应:O2+2H2O+4e-=4OH- | |
| C. | 工作时电子由b极经外电路流向a极 | |
| D. | 该装置实现了电能转化成化学能 |
①H2S ②H2SO3③Na2S ④Ca(OH)2 ⑤氯水 ⑥Na2SO3.
| A. | ①③④ | B. | ②⑤⑥ | C. | ①②④⑤ | D. | ②④⑤⑥ |
| A. | O4的摩尔质量是64g | |
| B. | O4与O3、O2互为同位素 | |
| C. | 相同质量的O4与O3所含原子个数之比为1:1 | |
| D. | 32gO4所含的电子数为32NA(NA为阿伏加德罗常数) |
| A. | 浓硝酸和氯水用棕色试剂瓶保存 | |
| B. | 硫化钠和硫酸亚铁固体长期暴露在空气中变质 | |
| C. | 常温下铁和铂都不溶于浓硝酸 | |
| D. | H2O2溶液中加入少量MnO2或FeCl3溶液都能增大反应速率 |
| A. | 水玻璃 | B. | 液氯 | C. | 漂白粉 | D. | 铝热剂 |
(1)实验室利用反应TiO2(s)+2CCl4(g)═TiCl4(g)+CO2(g),在无水无氧条件下,制取TiCl4实验装置示意图如下:
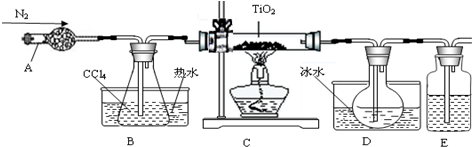
有关性质如表:
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
(2)工业上由钛铁矿(FeTiO3)(含Fe2O3、SiO2等杂质)制备TiO2的有关反应包括:
酸溶FeTiO3(s)+2H2SO4(aq)═FeSO4(aq)+TiOSO4(aq)+2H2O(l)
水解TiOSO4(aq)+2H2O(l)═H2TiO3(s)+H2SO4(aq)
简要工艺流程如下:
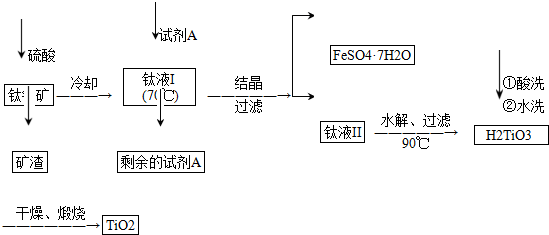
①试剂A为铁粉.钛液Ⅰ需冷却至70℃左右,若温度过高会导致产品收率降低,原因是由于TiOSO4容易水解,若温度过高,则会有较多TiOSO4水解为固体H2TiO3而经过滤进入FeSO4•7H2O中导致TiO2产率降低.
②取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是Fe2+.这种H2TiO3即使用水充分洗涤,煅烧后获得的TiO2也会发黄,发黄的杂质是Fe2O3(填化学式).
| X | ||
| Z |
| A. | 原子半径:r(Y)>r (Z)>r (W) | |
| B. | Y、Z、W的简单离子的电子层结构相同 | |
| C. | XWm与YWn中化学键类型相同(m、n为正整数) | |
| D. | 元素Z 的简单气态氢化物的热稳定性比W 的强 |
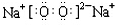 .
.