题目内容
现有等浓度的下列溶液:①CH3COOH ②HCl ③NaOH ④Na2CO3 ⑤NaCl按溶液pH由小到大排列正确的是( )
| A、①②⑤④③ |
| B、①④③②⑤ |
| C、⑤②①④③ |
| D、②①⑤④③ |
考点:盐类水解的应用,弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:等浓度的这几种溶液中,先根据酸碱盐进行分类,再根据酸的强弱、盐的类型进行分类,从而确定溶液酸碱性强弱.
解答:
解:等浓度的这几种溶液中,醋酸和盐酸都是酸、氯化钠和碳酸钠都是盐、氢氧化钠为强碱,醋酸的电离程度小于氯化氢,所以氯化氢pH小于醋酸;
碳酸钠为强碱弱酸盐,其溶液呈碱性,氯化钠为强酸强碱盐,其溶液呈中性;
氢氧化钠为强碱,所以这几种溶液pH由小到大顺序为:②①⑤④③,
故选D.
碳酸钠为强碱弱酸盐,其溶液呈碱性,氯化钠为强酸强碱盐,其溶液呈中性;
氢氧化钠为强碱,所以这几种溶液pH由小到大顺序为:②①⑤④③,
故选D.
点评:本题考查了溶液pH大小的判断,根据酸碱盐进行分类,再结合酸和盐的性质分析解答,再根据盐中“谁弱谁水解、谁强谁显性、强强显中性”判断,难度不大.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
在H2S的饱和溶液中存在下列平衡 ①H2S?H++HS-②HS-?H++S2-,且知K1>K2,采取下列哪种措施后,既可增大c(S2-)又能提高pH还能使电离平衡逆向移动的是( )
| A、加NaOH |
| B、通入H2S气体 |
| C、降温 |
| D、加入Na2S晶体 |
下列化学用语或模型正确的是( )
| A、CO2的结构式:O-C-0 |
B、氟化钠的电子式: |
C、CCl4分子的比例模型: |
D、金刚石的结构模型: |
在下列溶液中能大量共存的离子组是( )
| A、Fe3+、Na+、Cl-、SCN- | ||
B、HCO3-、Ca2+、C
| ||
| C、Na+、AlO2-、NO3-、H+ | ||
| D、K+、Na+、Cl-、SO42- |
以石墨做电极,电解1mol/L下列物质的水溶液,下列表述正确的是( )
| A、若为盐酸溶液,pH减小 |
| B、若为氢氧化钠溶液,pH减小 |
| C、若为硫酸钠溶液,pH不变 |
| D、若为氯化钠溶液,pH不变 |
设阿伏加德罗常数为NA,下列叙述中正确的是( )
| A、常温常压下,32克氧气中原子个数为NA |
| B、标准状况下,1mol H2O的体积为22.4L |
| C、常温常压下,1mol H2的质量为2克 |
| D、物质的量浓度为0.5mol/L的MgCl2溶液中,含有的Cl-数为NA |
 元素周期表是学习化学的一种重要工具.A、B、C、D、E、F是周期表中前四周期的六种元素,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E少一个电子层,E原子得到一个电子后3p轨道全充满;D最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F有+1、+2两种常见的化合价,其单质为红色.回答下列问题:
元素周期表是学习化学的一种重要工具.A、B、C、D、E、F是周期表中前四周期的六种元素,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E少一个电子层,E原子得到一个电子后3p轨道全充满;D最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F有+1、+2两种常见的化合价,其单质为红色.回答下列问题: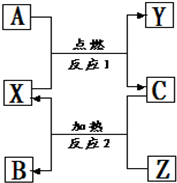 A、B、C是中学化学常见的单质,X、Y、Z是中学化学常见的氧化物,它们之间有如右图所示的转化关系,请据图回答:
A、B、C是中学化学常见的单质,X、Y、Z是中学化学常见的氧化物,它们之间有如右图所示的转化关系,请据图回答: