题目内容
15.X、Y、Z、M、N代表五种金属.有以下化学反应:①水溶液中:X+Y2+═X2++Y
②Z+2H2O(冷)═Z(OH)2+H2↑
③M、N为电极与N盐溶液组成原电池,发生的电极反应为:M-2e-═M2+
④Y可以溶于稀H2SO4中,M不被稀H2SO4氧化.
则这五种金属的活泼性由弱到强的顺序是( )
| A. | M<N<Y<X<Z | B. | Y<X<N<M<Z | C. | N<M<Y<X<Z | D. | X<Z<N<M<Y |
分析 金属的金属性越强,其单质的还原性越强;在原电池中,一般来说,较活泼金属作负极、较不活泼金属作正极,负极上失电子发生氧化反应,正极上得电子发生还原反应;在金属活动性顺序表中,位于氢之前的金属能置换出酸中的氢,据此分析解答.
解答 解:金属的金属性越强,其单质的还原性越强;在原电池中,一般来说,较活泼金属作负极、较不活泼金属作正极,负极上失电子发生氧化反应,正极上得电子发生还原反应;在金属活动性顺序表中,位于氢之前的金属能置换出酸中的氢,
①水溶液中X+Y2+═X2++Y,说明活动性X>Y;
②Z+2H2O(冷水)═Z(OH)2+H2↑,能与冷水反应生成氢气说明Z金属性活动性很强;
③M、N为电极,与N盐溶液组成原电池,M电极反应为M-2e-═M2+,M失电子发生氧化反应,则M是负极、N是正极,活动性M>N;
④Y可以溶于稀硫酸中,M不被稀硫酸氧化,说明活动性Y>M,
通过以上分析知,金属活动性顺序N<M<Y<X<Z,
故选C.
点评 本题考查金属活动性强弱顺序判断,为高频考点,利用金属与酸或水反应置换出氢气难易程度、金属最高价氧化物的水化物碱性强弱、金属之间的置换反应等可以判断金属性强弱,注意不能根据失电子多少判断,为易错点,题目难度中等.

练习册系列答案
相关题目
5.当光束通过下列分散系时,能观察到丁达尔效应的是( )
| A. | 泥水 | B. | 盐酸 | C. | Fe(OH)3胶体 | D. | NaCl溶液 |
6.某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还含有一定量的SiO2)可用于制备FeCO3,其流程如图:
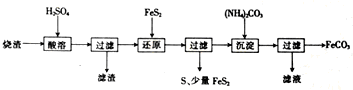
已知:还原时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ为FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+.
(1)反应Ⅰ中还原剂是FeS2.
(2)滤渣的成分是二氧化硅(填名称).
(3)所得FeCO3需充分洗涤,检验FeCO3是否洗净的方法是取少许最后一次洗涤液于试管中,滴加稀盐酸,待无明显现象后,再滴加BaCl2溶液,若无白色沉淀生成,则表明已洗涤干净.反之,则说明没洗涤干净.
(4)①配平反应Ⅱ的离子方程式:2Fe3++1FeS2=2S↓+3Fe2+.
②还原前后溶液中部分离子的浓度见表(溶液体积变化忽略不计):
则反应Ⅰ、Ⅱ中生成Fe2+的物质的量之比为5:3.

已知:还原时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ为FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+.
(1)反应Ⅰ中还原剂是FeS2.
(2)滤渣的成分是二氧化硅(填名称).
(3)所得FeCO3需充分洗涤,检验FeCO3是否洗净的方法是取少许最后一次洗涤液于试管中,滴加稀盐酸,待无明显现象后,再滴加BaCl2溶液,若无白色沉淀生成,则表明已洗涤干净.反之,则说明没洗涤干净.
(4)①配平反应Ⅱ的离子方程式:2Fe3++1FeS2=2S↓+3Fe2+.
②还原前后溶液中部分离子的浓度见表(溶液体积变化忽略不计):
| 离子 | 离子浓度(mol?L-1) | |
| 还原前 | 还原后 | |
| Fe2+ | 0.10 | 2.50 |
| SO42- | 3.50 | 3.70 |
10.常温下,下列各组离子在相应的条件下可能大量共存的是( )
| A. | 能使pH试纸变红的溶液中:CO32-、K+、Cl-、Na+ | |
| B. | $\frac{{K}_{w}}{c({H}^{+})}$=10-10mol/L的溶液中:Na+、HCO3-、Cl-、K+ | |
| C. | 在$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×1012的溶液中:NH4+、Fe2+、Cl-、NO3- | |
| D. | 由水电离产生的c(OH-)=1×10-12mol/L的溶液中:NO3-、Mg2+、Na+、SO42- |
7.增塑剂DCHP可由邻苯二甲酸酐与环己醇反应制得,下列叙述正确的是( )
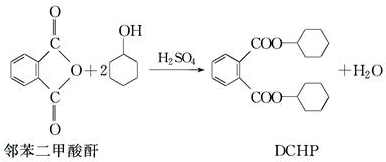

| A. | 邻苯二甲酸酐属于酸性氧化物 | |
| B. | 环己醇分子中所有的原子可能共平面 | |
| C. | DCHP能发生加成、取代、消去反应 | |
| D. | 1molDCHP最多可与含2molNaOH的烧碱溶液反应 |
4. 利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.
利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.
已知:①CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.2kJ•mol-1
②CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42.3kJ•mol-1
(1)甲烷和水蒸气生成二氧化碳和氢气的热化学方程式CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=+163.9 kJ/mol.
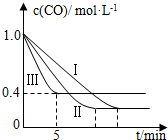
(2)为了探究反应条件对反应CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42.3kJ•mol-1的影响,某活动小组设计了三个实验,实验曲线如图所示.
①请依据实验曲线图补充完整表格中的实验条件:X=530℃,Y=5MPa.
②实验Ⅲ从开始至平衡,其平均反应速度率v (CO)=0.12mol•L-1•min-1.
③实验Ⅱ达平衡时CO的转化率大于 实验Ⅲ达平衡时CO的转化率(填“大于”、“小于”或“等于”).
④在530℃时,平衡常数K=1,若往1L容器中投入0.2mol CO(g)、0.2mol H2O(g)、1mol CO2(g)、0.1mol H2(g),此时化学反应将向逆方向(填“向正方向”、“向逆方向”或“不”) 移动.
 利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.
利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.已知:①CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.2kJ•mol-1
②CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42.3kJ•mol-1
(1)甲烷和水蒸气生成二氧化碳和氢气的热化学方程式CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=+163.9 kJ/mol.
(2)为了探究反应条件对反应CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42.3kJ•mol-1的影响,某活动小组设计了三个实验,实验曲线如图所示.
| 编号 | 温度 | 压强 | c始(CO) | c始(H2O) |
| Ⅰ | 530℃ | 3MPa | 1.0mol•L-1 | 3.0mol•L-1 |
| Ⅱ | X | Y | 1.0mol•L-1 | 3.0mol•L-1 |
| Ⅲ | 630℃ | 5MPa | 1.0mol•L-1 | 3.0mol•L-1 |
②实验Ⅲ从开始至平衡,其平均反应速度率v (CO)=0.12mol•L-1•min-1.
③实验Ⅱ达平衡时CO的转化率大于 实验Ⅲ达平衡时CO的转化率(填“大于”、“小于”或“等于”).
④在530℃时,平衡常数K=1,若往1L容器中投入0.2mol CO(g)、0.2mol H2O(g)、1mol CO2(g)、0.1mol H2(g),此时化学反应将向逆方向(填“向正方向”、“向逆方向”或“不”) 移动.
5.氯气是一种有毒气体,在运输和储存过程中必须防止泄露.若储存液氯的钢瓶发生泄露,立即采取的措施中错误的是( )
| A. | 将人群向低处疏散 | B. | 将人群逆风向疏散 | ||
| C. | 用浸有水的毛巾捂住口鼻 | D. | 向泄露地点撒一些石灰 |
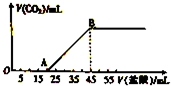 将5.08g由Na2CO3和NaHCO3组成的固体混合物完全溶于水,制成溶液,然后向该溶液中逐滴加入2mol?L-1的盐酸,所加入盐酸的体积与产生CO2体积(标准状况)的关系如图所示.
将5.08g由Na2CO3和NaHCO3组成的固体混合物完全溶于水,制成溶液,然后向该溶液中逐滴加入2mol?L-1的盐酸,所加入盐酸的体积与产生CO2体积(标准状况)的关系如图所示. 某同学组装了如图所示的电化学装置.电极Ⅰ为Al,其他电极均为Cu.
某同学组装了如图所示的电化学装置.电极Ⅰ为Al,其他电极均为Cu.