题目内容
13.某溶液中含有大量的Ca2+、Cl-、NH${\;}_{4}^{+}$,还可能大量存在的离子是( )| A. | H+ | B. | OH- | C. | Ag+ | D. | CO${\;}_{3}^{2-}$ |
分析 根据离子之间结合生成沉淀、气体、水、弱电解质等,则离子大量共存,并结合离子的颜色来解答.
解答 解:A.该组离子之间均不反应,可大量共存,故A正确;
B.NH4+、OH-结合生成弱电解质一水合氨,不能大量共存,故B错误;
C.Cl-、Ag+结合生成沉淀,不能大量共存,故C错误;
D.Ca2+、CO32-结合生成沉淀,不能大量共存,故D错误.
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
1.下列关于乙烯的说法正确的是( )
| A. | 是天然气的主要成分 | B. | 能使溴的四氯化碳溶液褪色 | ||
| C. | 不能发生燃烧反应 | D. | 不能发生加聚反应 |
8.我国自主研制的嫦娥三号月球探测器的动力能源是太阳能电池,制造太阳能电池的主要材料是( )
| A. | 锂 | B. | 硅 | C. | 镍 | D. | 二氧化硅 |
18.下列反应的离子方程式书写正确的是( )
| A. | 铝粉投入氢氧化钠溶液中:2Al+2OH-═2AlO${\;}_{2}^{-}$+H2↑ | |
| B. | 硫酸与氢氧化钠溶液反应:H++OH-═H2O | |
| C. | 大理石与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 硫酸铜溶液和氢氧化钡溶液反应:Ba2++SO${\;}_{4}^{2-}$═BaSO4↓ |
2.已知下列数据:

实验室制乙酸乙酯的主要装置如图1所示,主要步骤为:①在30mL的大试管中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合液;②按照图I连接装置,使产生的蒸气经导管通到15mL试管所盛饱和Na2CO3溶液(加入1滴酚酞试液)上方2mm~3mm处,③小火加热试管中的混合液;④待小试管中收集约4mL产物时停止加热,撤出小试管并用力振荡,然后静置待其分层;⑤分离出纯净的乙酸乙酯.
请同学们回答下列问题:
(1)写出该反应的化学方程式CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,浓H2SO4的作用是催化剂、吸水剂.
(2)步骤④所观察到的现象是在浅红色Na2CO3溶液上层有约4cm厚的无色液体,振荡后Na2CO3溶液层红色变浅,有气泡,上层液体变薄,原因是上层是油层因为生成的乙酸乙酯难溶于水,且密度比水小,同时因为挥发出来的乙酸与碳酸钠反应,放出CO2气体,所以有气泡出现.
(3)步骤⑤中,分离出乙酸乙酯选用的仪器是分液漏斗.
(4)为提高乙酸乙酯的产率,甲、乙两位同学分别设计了如图2甲、乙的装置(乙同学待反应完毕冷却后再用饱和Na2CO3溶液提取烧瓶中产物).你认为哪种装置合理,为什么?答:乙,反应物能冷凝回流.
| 物 质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 |
| 乙 醇 | -114 | 78 | 0.789 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.900 |
| 浓H2SO4 | 338 | 1.84 |

实验室制乙酸乙酯的主要装置如图1所示,主要步骤为:①在30mL的大试管中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合液;②按照图I连接装置,使产生的蒸气经导管通到15mL试管所盛饱和Na2CO3溶液(加入1滴酚酞试液)上方2mm~3mm处,③小火加热试管中的混合液;④待小试管中收集约4mL产物时停止加热,撤出小试管并用力振荡,然后静置待其分层;⑤分离出纯净的乙酸乙酯.
请同学们回答下列问题:
(1)写出该反应的化学方程式CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,浓H2SO4的作用是催化剂、吸水剂.
(2)步骤④所观察到的现象是在浅红色Na2CO3溶液上层有约4cm厚的无色液体,振荡后Na2CO3溶液层红色变浅,有气泡,上层液体变薄,原因是上层是油层因为生成的乙酸乙酯难溶于水,且密度比水小,同时因为挥发出来的乙酸与碳酸钠反应,放出CO2气体,所以有气泡出现.
(3)步骤⑤中,分离出乙酸乙酯选用的仪器是分液漏斗.
(4)为提高乙酸乙酯的产率,甲、乙两位同学分别设计了如图2甲、乙的装置(乙同学待反应完毕冷却后再用饱和Na2CO3溶液提取烧瓶中产物).你认为哪种装置合理,为什么?答:乙,反应物能冷凝回流.
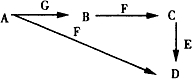 A~G为中学化学中常见的物质,B、E、F为单质,在常温下B是一种有色气体,G为黑色的固体.它们的相互转化如图所示,部分生成物未列出.试回答下列问题
A~G为中学化学中常见的物质,B、E、F为单质,在常温下B是一种有色气体,G为黑色的固体.它们的相互转化如图所示,部分生成物未列出.试回答下列问题