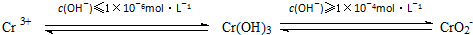题目内容
结构为…-CH=CH-CH=CH-CH=CH-CH=CH-…的高分子化合物用碘蒸气处理后,其导电能力大幅度提高.上述高分子化合物的单体是( )
| A、乙炔 | B、乙烯 |
| C、丙烯 | D、1,3-丁二烯 |
考点:聚合反应与酯化反应
专题:有机反应
分析:判断高聚物的单体:首先要根据高聚物的结构简式判断高聚物是加聚产物还是缩聚产物,然后根据推断单体的方法作出判断,
加聚产物的单体推断方法:
(1)凡链节的主链上只有两个碳原子(无其它原子)的高聚物,其合成单体必为一种,将两半链闭合即可;
(2)凡链节主链上只有四个碳原子(无其它原子)且链节无双键的高聚物,其单体必为两种,在正中间画线断开,然后将四个半键闭合即可;
(3)凡链节中主碳链为6个碳原子,其规律是“见双键,四个碳,无双键,两个碳”画线断开,然后将半键闭合,即将单双键互换;
该题属于第(1)种情况,据此进行解答.
加聚产物的单体推断方法:
(1)凡链节的主链上只有两个碳原子(无其它原子)的高聚物,其合成单体必为一种,将两半链闭合即可;
(2)凡链节主链上只有四个碳原子(无其它原子)且链节无双键的高聚物,其单体必为两种,在正中间画线断开,然后将四个半键闭合即可;
(3)凡链节中主碳链为6个碳原子,其规律是“见双键,四个碳,无双键,两个碳”画线断开,然后将半键闭合,即将单双键互换;
该题属于第(1)种情况,据此进行解答.
解答:
解:高分子化合物…CH=CH-CH=CH-CH=CH-CH=CH…,其结构简式可以表示为:-[CH=CH]-n,属于加聚产物,根据加聚产物的单体推断方法,凡链节的主链上只有两个碳原子(无其它原子)的高聚物,其合成单体必为一种,将两半键闭合即可得其单体为:CH≡CH,
故选A.
故选A.
点评:本题考查加聚反应生原理及高分子化合物单体的求算,题目难度不大,明确加聚反应原理及反应产物的单体判断方法是解答的关键.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
下列化学方程式中,不能用H++OH-=H2O表示的是( )
| A、2NaOH+H2SO4=Na2SO4+2H2O |
| B、NaOH+HCl=NaCl+H2O |
| C、Ba(OH)2+H2SO4=BaSO4↓+2H2O |
| D、KOH+HCl=KCl+H2O |
下列各组中两种微粒所含电子数不相等的是( )
| A、H3O+和OH- |
| B、CO和N2 |
| C、HNO2和 NO2- |
| D、CH3+和NH4+ |
下面离子方程式书写不正确的是( )
| A、消毒液与洁厕灵混合使用会产生有毒气体:Cl-+ClO-+2H+═Cl2↑+H2O | ||||
B、用惰性电极电解AlCl3溶液会产生白色沉淀:2Al3++6Cl-+6H2O
| ||||
| C、在重铬酸钾溶液中滴入NaOH溶液,溶液变为黄色:Cr2O72-+2OH-═2CrO42-+H2O | ||||
| D、草酸使得酸性高锰酸钾溶液褪色:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O |
下列关于硅及化合物的叙述正确的是( )
| A、玛瑙的主要成分是硅酸盐 |
| B、晶体硅和二氧化硅晶体都常用来制造电子部件 |
| C、硅和二氧化硅都不与酸反应 |
| D、硅和二氧化硅都广泛存在于自然界中,天然单质硅叫硅石 |
100mL 0.1mol?L-1的碳酸钠溶液所含碳酸钠的质量是( )
| A、10.6g | B、1.06g |
| C、0.53g | D、106g |
下列物质易溶于水的是( )
| A、硝酸钾 | B、氮气 |
| C、一氧化碳 | D、氯化银 |
下列收集Cl2的正确装置正确且环保的是( )
A、 |
B、 |
C、 |
D、 |
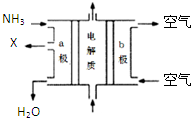 工业废水中含有多种有害成分,任意排放将造成严重污染,进行分类处理达标后才能排放.
工业废水中含有多种有害成分,任意排放将造成严重污染,进行分类处理达标后才能排放.