题目内容
4.燃料的使用和防污染是社会发展中一个无法回避的矛盾话题.(1)我国北方冬季烧煤供暖所产生的废气是雾霾的主要来源之一.经研究发现将煤炭在O2/CO2的气氛下燃烧,能够降低燃煤时NO的排放,主要反应为:
2NO(g)+2CO(g)═N2(g)+2CO2(g)△H
若①N2(g)+O2(g)═2NO(g)△H1=+180.5kJ•mol-1
②2CO(g)═2C(s)+O2(g)△H2=+221kJ•mol-1
③C(s)+O2(g)═CO2(g)△H3=-393.5kJ•mol-1
则△H=-746.5kJ•mol-1.
(2)为了提高燃料的利用率,可以将甲醇设计为燃料电池,写出熔融K2CO3做电解质时,甲醇燃料电池的负极反应式:CH3OH-6e-+3CO32-=2H2O+4CO2↑;该电池负极与水库的铁闸相连时,可以保护铁闸不被腐蚀,这种方法叫做外加电流的阴极保护法.
(3)含有甲醇的废水随意排放会造成水污染,可用ClO2将其氧化为CO2,然后再加碱中和即可.写出处理甲醇酸性废水过程中,ClO2与甲醇反应的离子方程式:6ClO2+5CH3OH=6Cl-+5CO2+6H++7H2O.
(4)机动车的尾气也是雾霾形成的原因之一.
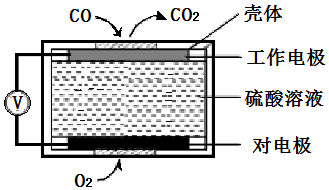
①近几年有人提出在催化剂条件下,利用汽油中挥发出来的C3H6催化还原尾气中的NO气体生成三种无污染的物质.请写出该过程的化学方程式:2C3H6+18NO=6CO2+9N2+6H2O;
②电化学气敏传感器法是测定汽车尾气常用的方法之一.其中CO传感器的工作原理如上图所示,则对电极的电极反应式为O2+4e-+4H+=2H2O.
分析 (1)②+③×2-①得到2NO(g)+2CO(g)?N2(g)+2CO2(g),据此计算反应的焓变;
(2)负极发生氧化反应,甲醇燃料电池的负极反应式:CH3OH-6e-+3CO32-=2H2O+4CO2↑;该电池负极与水库的铁闸相连时,可以保护铁闸不被腐蚀,这种方法叫做外加电流的阴极保护法;
(3)根据信息:二氧化氯和甲醇反应,生成Cl-、CO2和水2,配平方程式即可;
(4)①C3H6催化还原尾气中的NO气体,发生氧化还原反应生成无毒气体二氧化碳和氮气;
②电化学气敏传感器法是测定汽车尾气常用的方法之一.其中CO传感器的工作原理如上图所示,对电极氧气发生还原反应,电极反应式为O2+4e-+4H+=2H2O.
解答 解:(1)②+③×2-①得到2NO(g)+2CO(g)?N2(g)+2CO2(g),反应的焓变=+221kJ•mol-1+2(-393.5kJ•mol-1)-(180.5kJ•mol-1)=-746.5kJ•mol-1,
故答案为:-746.5;
(2)负极发生氧化反应,甲醇燃料电池的负极反应式:CH3OH-6e-+3CO32-=2H2O+4CO2↑;该电池负极与水库的铁闸相连时,可以保护铁闸不被腐蚀,这种方法叫做外加电流的阴极保护法,故答案为:CH3OH-6e-+3CO32-=2H2O+4CO2↑;外加电流的阴极保护法;
(3)根据信息:二氧化氯和甲醇反应,生成Cl-、CO2和水2,所以反应方程式为:6ClO2+5CH3OH=6Cl-+5CO2+6H++7H2O,故答案为:6ClO2+5CH3OH=6Cl-+5CO2+6H++7H2O;
(4)①C3H6催化还原尾气中的NO气体,发生氧化还原反应生成无毒气体二氧化碳和氮气,所以反应方程式为:2C3H6+18NO=6CO2+9N2+6H2O,故答案为:2C3H6+18NO=6CO2+9N2+6H2O;
②电化学气敏传感器法是测定汽车尾气常用的方法之一.其中CO传感器的工作原理如上图所示,对电极氧气发生还原反应,电极反应式为O2+4e-+4H+=2H2O,故答案为:O2+4e-+4H+=2H2O.
点评 本题考查盖斯定律的应用、氧化还原反应反应的分析以及电解原理的分析应用等,比较综合,题目难度中等,侧重于考查学生的分析能力和对基础知识的综合应用能力.

 阅读快车系列答案
阅读快车系列答案| A. | 葡萄糖 | B. | 食盐水 | C. | 硫酸钠溶液 | D. | 氢氧化钠 |
| 物质 | X | Y | Z | Q |
| 时间 | ||||
| 起始/mol | 0.7 | 1 | ||
| 2min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
| 3min末/mol | 0.8 |
(1)2min内Z的反应速率v(Z)=0.05mol•L-1•min-1.
(2)试确定以下物质的相关量:起始时n(Y)=2.3mol,n(Q)=3mol.
(3)方程式中m=1,n=4,p=2,q=3.
(4)对于该反应,能增大正反应速率的措施是CD
A.增大容器体积 B.移走部分Q C.通入大量X D.升高温度.
| A. | SO2+2H2S═S+2H2O | B. | 2NaNO3$\frac{\underline{\;\;△\;\;}}{\;}$2NaNO2+O2↑ | ||
| C. | NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$N2O↑+2H2O | D. | 3Cl2+6KOH═5KCl+KClO3+3H2O |
 根据组成原电池的条件,试以反应:2Fe3++Cu=2Fe2++Cu2+设计一个原电池,
根据组成原电池的条件,试以反应:2Fe3++Cu=2Fe2++Cu2+设计一个原电池, (1)反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.
(1)反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题. 进行化学实验必须注意安全,下列说法中正确的组合是( )
进行化学实验必须注意安全,下列说法中正确的组合是( )