题目内容
甲醇(CH3OH )-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,该燃料电池的电池反应式为:CH3OH+
O2=CO2+2H2O.其工作原理示意图如图甲:
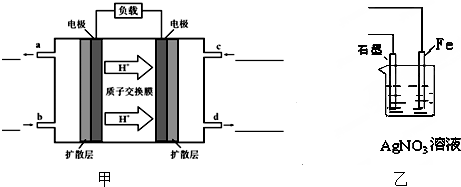
请回答下列问题:
(1)写出甲图中b、c两个入口通入的物质:b c .
(2)负极的电极反应式为 .
(3)用该原电池电解AgNO3溶液(如图乙),若Fe电极增重5.4g,则:
①阴极材料为 ,阳极电极反应式为 .
②燃料电池在理论上消耗的氧气的体积为 mL(标准状况)
③若要使AgNO3溶液恢复到电解前状态,则应加入 g .(填物质的化学式)
| 3 |
| 2 |

请回答下列问题:
(1)写出甲图中b、c两个入口通入的物质:b
(2)负极的电极反应式为
(3)用该原电池电解AgNO3溶液(如图乙),若Fe电极增重5.4g,则:
①阴极材料为
②燃料电池在理论上消耗的氧气的体积为
③若要使AgNO3溶液恢复到电解前状态,则应加入
考点:化学电源新型电池,电解原理
专题:电化学专题
分析:(1)根据质子移动方向知,右边电极为正极、左边电极为负极,燃料电池中,通入燃料的电极为负极、通入氧化剂的电极为正极;
(2)电解质溶液为酸性,则负极上甲醇失电子和水反应生成二氧化碳和氢离子;
(3)①Fe电极质量增加,说明Fe为阴极、石墨作阳极,阳极上氢氧根离子放电;
②根据转移电子相等计算消耗氧气体积;
③根据析出什么加入什么原子加入物质.
(2)电解质溶液为酸性,则负极上甲醇失电子和水反应生成二氧化碳和氢离子;
(3)①Fe电极质量增加,说明Fe为阴极、石墨作阳极,阳极上氢氧根离子放电;
②根据转移电子相等计算消耗氧气体积;
③根据析出什么加入什么原子加入物质.
解答:
解:(1)根据质子移动方向知,右边电极为正极、左边电极为负极,燃料电池中,通入燃料的电极为负极、通入氧化剂的电极为正极,所以b、c通入的物质分别是CH3OH、O2,故答案为:CH3OH;O2;
(2)电解质溶液为酸性,则负极上甲醇失电子和水反应生成二氧化碳和氢离子,电极反应式为CH3OH+H2O-6e-=CO2↑+6H+,故答案为:CH3OH+H2O-6e-=CO2↑+6H+;
(3)①Fe电极质量增加,说明Fe为阴极、石墨作阳极,阳极上氢氧根离子放电,电极反应式为,故答案为:4OH--4e-=O2↑+2H2O,故答案为:Fe(铁);4OH--4e-=O2↑+2H2O;
②Fe电极电极反应式为Ag+e-=Ag,增重5.4g时转移电子的物质的量=
×1=0.05mol,串联电路中转移电子相等,燃料电池中正极反应式为O2+4e-+2H2O=4OH-,根据O2~4e-得消耗氧气体积
×22.4L/mol=280mL,故答案为:280;
③电解时,阳极上生成氧气质量=
×32g/mol=0.4g,阴极上析出Ag的质量为5.4g,所以电解质溶液减少质量为5.8g,实际上电解质溶液减少的质量相当于 Ag2O质量,根据析出什么加入什么原则知,加入5.8g Ag2O即可,故答案为:5.8;Ag2O.
(2)电解质溶液为酸性,则负极上甲醇失电子和水反应生成二氧化碳和氢离子,电极反应式为CH3OH+H2O-6e-=CO2↑+6H+,故答案为:CH3OH+H2O-6e-=CO2↑+6H+;
(3)①Fe电极质量增加,说明Fe为阴极、石墨作阳极,阳极上氢氧根离子放电,电极反应式为,故答案为:4OH--4e-=O2↑+2H2O,故答案为:Fe(铁);4OH--4e-=O2↑+2H2O;
②Fe电极电极反应式为Ag+e-=Ag,增重5.4g时转移电子的物质的量=
| 5.4g |
| 108g/mol |
| 0.05mol |
| 4 |
③电解时,阳极上生成氧气质量=
| 0.05mol |
| 4 |
点评:本题考查了原电池和电解池原理,正确判断甲中正负极、乙中阴阳极是解本题关键,会正确书写电极反应式,知道串联电路中转移电子相等,题目难度不大.

练习册系列答案
相关题目
下列说法正确的是( )
| A、摩尔是物质的质量单位 |
| B、氢气的摩尔质量是2g |
| C、1mol H3O+ 的质量是19g |
| D、气体摩尔体积是指单位物质的量的物质所占的体积 |
海水中可以提取镁,其方法是首先使海水中的Mg2+转化为Mg(OH)2沉淀.从经济效益的角度考虑,可在海水中加入的物质是( )
| A、NaOH |
| B、KOH |
| C、CaO |
| D、Na2O |
KO3、KO2、K2O2和Na2O2相似,也能和CO2反应.物质的量相同的KO3、KO2、K2O2分别和足量的CO2反应生成的O2的物质的量之比为( )
| A、1:1:1 |
| B、1:2:3 |
| C、2:3:5 |
| D、5:3:2 |

