题目内容
图1为一定量AlCl3溶液中加入NaOH溶液后,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线.试回答:

Ⅰ.A点时已参加反应的AlCl3和NaOH的物质的量之比为1比 ;
Ⅱ.B处溶液中存在的浓度最大的离子是 (填离子符号);向B处生成的溶液中通入过量的二氧化碳,可见到的现象是(用离子方程式来表示) ;
Ⅲ.铝铵矾是一种复盐,其主要化学成分为十二水硫酸铝铵NH4Al(SO4)2.12H2O,向该盐的浓溶液中逐滴加入浓NaOH溶液,将发生一系列变化,已知NH4+与AlO2-在水溶液中不能大量共存,会发生如下反应:
NH4++AlO2-+H2O=Al(OH)3↓+NH3↑.试回答:
(1)写出硫酸铝铵在水溶液中电离的方程式: ;
(2)在逐滴加入NaOH溶液的过程中,产生的现象有:
①溶液中出现白色沉淀;②有刺激性气味的气体放出;③白色沉淀量逐渐增多;④白色沉淀完全消失:⑤白色沉淀逐渐减少.请排出以上各种现象由先到后出现的正确顺序(用序号答) ;
(3)向含有0.1mol NH4Al(SO4)2溶液中逐滴加入5mol?L-1NaOH溶液,请在图2中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图.

Ⅰ.A点时已参加反应的AlCl3和NaOH的物质的量之比为1比
Ⅱ.B处溶液中存在的浓度最大的离子是
Ⅲ.铝铵矾是一种复盐,其主要化学成分为十二水硫酸铝铵NH4Al(SO4)2.12H2O,向该盐的浓溶液中逐滴加入浓NaOH溶液,将发生一系列变化,已知NH4+与AlO2-在水溶液中不能大量共存,会发生如下反应:
NH4++AlO2-+H2O=Al(OH)3↓+NH3↑.试回答:
(1)写出硫酸铝铵在水溶液中电离的方程式:
(2)在逐滴加入NaOH溶液的过程中,产生的现象有:
①溶液中出现白色沉淀;②有刺激性气味的气体放出;③白色沉淀量逐渐增多;④白色沉淀完全消失:⑤白色沉淀逐渐减少.请排出以上各种现象由先到后出现的正确顺序(用序号答)
(3)向含有0.1mol NH4Al(SO4)2溶液中逐滴加入5mol?L-1NaOH溶液,请在图2中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图.
考点:离子方程式的有关计算,镁、铝的重要化合物
专题:计算题
分析:Ⅰ.一定量AlCl3溶液中加入NaOH溶液后,随氢氧化钠溶液的加入,先生成氢氧化铝沉淀,达到最大后继续加入氢氧化钠溶液,氢氧化铝沉淀溶解,依据化学方程式的定量关系计算得到;
Ⅱ.B处溶液时正好无沉淀,发生反应AlCl3+4NaOH=NaAlO2+2H2O+3NaCl;B处是氢氧化铝溶解生成的偏铝酸钠溶液,通入过量的二氧化碳会反应生成氢氧化铝白色沉淀;
Ⅲ.(1)硫酸铝铵是强电解质完全电离;
(2)铵根和铝离子在溶液中共存时,铝离子先和氢氧根离子生成沉淀,然后是铵根离子和碱的反应,接下来是氢氧化铝和氢氧根离子的反应,根据铵根离子、铝离子、偏铝酸根和氢氧根之间的反应的离子方程式确定离子的量的多少;
(3)含有0.1mol NH4Al(SO4)2溶液中含有NH4+离子0.1mol,Al3+物质的量为0.1mol,逐滴加入5mol?L-1 NaOH溶液,发生反应的离子方程式为:
Al3++3OH-=Al(OH)3↓,NH4++OH-=NH3?H2O,Al(OH)3+OH-=AlO2-+H2O.依据反应的过程和物质的量绘制图象.
Ⅱ.B处溶液时正好无沉淀,发生反应AlCl3+4NaOH=NaAlO2+2H2O+3NaCl;B处是氢氧化铝溶解生成的偏铝酸钠溶液,通入过量的二氧化碳会反应生成氢氧化铝白色沉淀;
Ⅲ.(1)硫酸铝铵是强电解质完全电离;
(2)铵根和铝离子在溶液中共存时,铝离子先和氢氧根离子生成沉淀,然后是铵根离子和碱的反应,接下来是氢氧化铝和氢氧根离子的反应,根据铵根离子、铝离子、偏铝酸根和氢氧根之间的反应的离子方程式确定离子的量的多少;
(3)含有0.1mol NH4Al(SO4)2溶液中含有NH4+离子0.1mol,Al3+物质的量为0.1mol,逐滴加入5mol?L-1 NaOH溶液,发生反应的离子方程式为:
Al3++3OH-=Al(OH)3↓,NH4++OH-=NH3?H2O,Al(OH)3+OH-=AlO2-+H2O.依据反应的过程和物质的量绘制图象.
解答:
解:Ⅰ.分析图象可知,A点是氯化铝和氢氧化钠反应生成氢氧化铝和氯化钠的反应,反应的化学方程式为:AlCl3+3NaOH=Al(OH)3↓+3NaCl,A点时已参加反应的AlCl3和NaOH的物质的量之比为1:3,
故答案为:1:3;
Ⅱ.B处溶液时正好无沉淀,发生反应AlCl3+4NaOH=NaAlO2+2H2O+3NaCl,故B处溶液中存在的浓度最大的离子为Na+
向B处生成的溶液中通入过量的二氧化碳,可发生反应AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,反应生成白色沉淀,
故答案为:Na+;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
Ⅲ.(1)硫酸铝铵是强电解质完全电离,电离方程式为NH4Al(SO4)2=NH4++Al3++2SO42-,
故答案为:NH4Al(SO4)2=NH4++Al3++2SO42-;
(2)加入NaOH溶液,OH-能与NH4+和A13+作用,但由于 A13++3NH3?H2O=A1(OH)3↓+3NH4+,
即碱性NaOH>NH3?H2O>Al(OH)3,则先发生反应的是Al3+与OH-,最后 Al(OH)3逐渐溶解生成A1O2-,
故答案为:①③②⑤④;
(3)含有0.1mol NH4Al(SO4)2溶液中含有NH4+离子0.1mol,Al3+物质的量为0.1mol,逐滴加入5mol?L-1 NaOH溶液,发生反应的离子方程式为:Al3++3OH-=Al(OH)3↓,NH4++OH-=NH3?H2O,Al(OH)3+OH-=AlO2-+H2O,先生成氢氧化铝沉淀需要消耗氢氧化钠物质的量为0.3mol,体积=
=0.060L=60ml,和铵根离子反应消耗氢氧化钠物质的量为0.1mol,氢氧化钠溶液体积=
=0.020L=20ml,生成氢氧化铝沉淀物质的量量为0.1mol,溶解需要氢氧化钠物质的量为0.1mol,消耗氢氧化钠溶液的体积为20ml,依据沉淀量和消耗氢氧化钠溶液体积描出,
故答案为:

故答案为:1:3;
Ⅱ.B处溶液时正好无沉淀,发生反应AlCl3+4NaOH=NaAlO2+2H2O+3NaCl,故B处溶液中存在的浓度最大的离子为Na+
向B处生成的溶液中通入过量的二氧化碳,可发生反应AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,反应生成白色沉淀,
故答案为:Na+;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
Ⅲ.(1)硫酸铝铵是强电解质完全电离,电离方程式为NH4Al(SO4)2=NH4++Al3++2SO42-,
故答案为:NH4Al(SO4)2=NH4++Al3++2SO42-;
(2)加入NaOH溶液,OH-能与NH4+和A13+作用,但由于 A13++3NH3?H2O=A1(OH)3↓+3NH4+,
即碱性NaOH>NH3?H2O>Al(OH)3,则先发生反应的是Al3+与OH-,最后 Al(OH)3逐渐溶解生成A1O2-,
故答案为:①③②⑤④;
(3)含有0.1mol NH4Al(SO4)2溶液中含有NH4+离子0.1mol,Al3+物质的量为0.1mol,逐滴加入5mol?L-1 NaOH溶液,发生反应的离子方程式为:Al3++3OH-=Al(OH)3↓,NH4++OH-=NH3?H2O,Al(OH)3+OH-=AlO2-+H2O,先生成氢氧化铝沉淀需要消耗氢氧化钠物质的量为0.3mol,体积=
| 0.3mol |
| 5mol/L |
| 0.1mol |
| 5mol/L |
故答案为:

点评:本题考查了铝及其化合物性质的分析判断和计算应用,反应的定量关系是解题关键,题目难度中等.

练习册系列答案
相关题目
一种无色溶液中加入BaCl2溶液,生成不溶于稀HNO3的白色沉淀,则该溶液中含有的离子是( )
A、一定含有SO
| ||
B、一定含有CO
| ||
| C、可能有Ag+ | ||
D、一定有SO
|
 如图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量.下列选项编号对应的曲线编号错误的是( )
如图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量.下列选项编号对应的曲线编号错误的是( )| A、向NaAlO2溶液中逐渐滴入HCl至过量 |
| B、向澄清石灰水中通入SO2至过量 |
| C、向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量 |
| D、向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至过量 |
下列各组物质的溶液,不另加试剂无法一一鉴别的是( )
| A、NaOH HCl CuSO4 MgSO4 |
| B、Na2CO3 K2SO4 BaCl2 HCl |
| C、KNO3 HCl CaCl2 NaOH |
| D、NH4NO3 H2SO4 NaOH MgCl2 |
下列鉴别物质的方法能达到目的是( )
| A、用加热、称重的方法鉴别Na2CO3固体和NaHCO3固体 |
| B、用焰色反应鉴别NaCl固体和NaOH固体 |
| C、用KSCN溶液鉴别FeCl3溶液和Fe2(SO4)3溶液 |
| D、用丁达尔效应鉴别NaCl溶液和KCl溶液 |
用惰性电极分别电解下列物质的水溶液一段时间后,溶液的pH会升高的是( )
| A、Ba(NO3)2 |
| B、CuSO4 |
| C、HNO3 |
| D、NaOH |
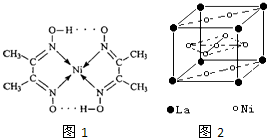 目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力.
目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力. 、④HCHO等,其中碳原子采取sp2杂化的分子有
、④HCHO等,其中碳原子采取sp2杂化的分子有