题目内容
用惰性电极分别电解下列物质的水溶液一段时间后,溶液的pH会升高的是( )
| A、Ba(NO3)2 |
| B、CuSO4 |
| C、HNO3 |
| D、NaOH |
考点:电解原理
专题:电化学专题
分析:用惰性电极电解电解质溶液,阳极的放电顺序:银离子>铜离子>氢离子>钠离子,阴极离子的放电顺序:氯离子>氢氧根离子>硫酸根(硝酸根)离子,根据两个电极的放电顺序,分析电解后溶液的成分来确定pH的变化.
解答:
解:A、电解硝酸钡溶液即电解水型的,溶液的PH不变,故错误;
B、电解CuSO4时,生成铜和氧气以及硫酸,溶液的PH降低,故B错误;
C、电解HNO3时,生成氢气和氧气,即电解水型的,酸的浓度升高,溶液的PH降低,故C错误;
D、电解NaOH时,生成氢气和氧气,即电解水型的,碱的浓度增大,溶液的PH升高,故D正确;
故选D.
B、电解CuSO4时,生成铜和氧气以及硫酸,溶液的PH降低,故B错误;
C、电解HNO3时,生成氢气和氧气,即电解水型的,酸的浓度升高,溶液的PH降低,故C错误;
D、电解NaOH时,生成氢气和氧气,即电解水型的,碱的浓度增大,溶液的PH升高,故D正确;
故选D.
点评:本题是对电解原理的考查,要求学生会根据电解原理书写常见电解质的电解反应,可以根据所学知识进行回答,难度不大.

练习册系列答案
相关题目
下列各组溶液,不用其它试剂,无法将它们区别开的是( )
| A、HCl、CuSO4、Mg(NO3)2、KOH |
| B、NaBr、AgNO3、HCl、Na2CO3 |
| C、H2SO4、NaCl、Na2SO4、Na2CO3 |
| D、NaOH、MgSO4、Na2CO3、KHSO4 |
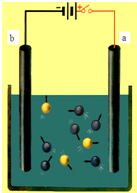 如图是电解氯化铜溶液的装置,其a、b为石墨电极,则下列有关的判断中正确的是( )
如图是电解氯化铜溶液的装置,其a、b为石墨电极,则下列有关的判断中正确的是( )| A、a为正极,b为负极 |
| B、a极上发生还原反应 |
| C、电解过程中,b电极上有铜析出 |
| D、电解过程中,氯离子浓度保持不变 |

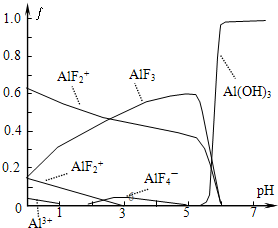 氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.
氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.