题目内容
13.将某NaOH溶液分成两等份,一份敞口放置于空气中,另一份密闭保存,一段时间后,往上述两份溶液中分别加入足量同浓度的稀盐酸,充分反应,消耗盐酸的质量( )| A. | 密闭保存的那份多 | B. | 敞口放置的那份多 | ||
| C. | 一样多 | D. | 无法比较 |
分析 氢氧化钠敞口放置,则2NaOH+CO2=Na2CO3+H2O,Na2CO3+2HCl=2NaCl+H2O+CO2↑;氢氧化钠和盐酸反应方程式为:NaOH+HCl=NaCl+H2O,根据钠元素、氯元素守恒计算二者消耗盐酸的体积关系.
解答 解:氢氧化钠敞口放置时,部分氢氧化钠与二氧化碳反应生成碳酸钠:2NaOH+CO2=Na2CO3+H2O,碳酸钠与盐酸的反应为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;
密闭保存时氢氧化钠和盐酸反应生成氯化钠和水:NaOH+HCl=NaCl+H2O,根据钠元素守恒,氢氧化钠中和碳酸钠中钠离子的物质的量是相等的,再和盐酸反应,都得到的是NaCl溶液,则n(Cl-)=n(Na+),
根据氯元素守恒可得:n(HCl)=n(Cl-)=n(Na+),所以二者消耗的HCl的物质的量相等,则消耗相同浓度的盐酸的体积一样多,
故选C.
点评 本题考查学生元素化合物的性质以及方程式的计算,题目难度不大,明确发生反应的实质为解答关键,注意掌握元素守恒思想在解题中的应用方法,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
3.在由水电离产生的c(H+)=1×10-14mol•L-1的溶液中,一定可以大量共存的离子组是( )
| A. | K+、Na+、SO42-、CO32- | B. | NH4+、Al3+、Br-、SO42- | ||
| C. | Na+、Mg2+、Cl-、NO3- | D. | K+、Ba2+、Cl-、NO3- |
4.在pH=1的无色溶液中能大量共存的离子组是( )
| A. | Na+ AlO2- SO42- NH4+ | B. | NH4+ Al3+ K+ Cl- | ||
| C. | MnO4- K+ NO3- Mg2+ | D. | Fe2+ NO3- Na+ SO42- |
18.将过量的CO2通入下列溶液中,最终出现浑浊的是( )
①CaCl2溶液;②石灰水;③饱和Na2CO3溶液;④水玻璃.
①CaCl2溶液;②石灰水;③饱和Na2CO3溶液;④水玻璃.
| A. | ①②③④ | B. | ②③④ | C. | ③④ | D. | ②④ |
5.下列实验能达到预期目的是( )
①用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸;
②用NaOH溶液除去苯中的少量苯酚;
③用饱和NaHCO3溶液除去CO2中的少量SO2;
④用加热方法提取NH4Cl固体中混有少量碘;
⑤用醋酸和澄清石灰水验证蛋壳中含有碳酸盐;
⑥用浓溴水除去苯中少量苯酚;
⑦用碘酒验证汽油中含有不饱和烃;
⑧用溴水除去甲烷中混有的少量乙烯.
①用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸;
②用NaOH溶液除去苯中的少量苯酚;
③用饱和NaHCO3溶液除去CO2中的少量SO2;
④用加热方法提取NH4Cl固体中混有少量碘;
⑤用醋酸和澄清石灰水验证蛋壳中含有碳酸盐;
⑥用浓溴水除去苯中少量苯酚;
⑦用碘酒验证汽油中含有不饱和烃;
⑧用溴水除去甲烷中混有的少量乙烯.
| A. | ①②⑥⑦⑧ | B. | ①③⑤⑥⑦ | C. | ②③⑤⑦⑧ | D. | ②③④⑤⑦ |
2.下列说法正确的是( )
| A. | MgO、Al2O3的熔点很高,可作耐高温材料,工业上用热还原法冶炼对应的金属 | |
| B. | 氢氧化钠、碳酸氢钠、氢氧化铝都可用作抗酸药 | |
| C. | 甲醛的水溶液具有杀菌、防腐的作用,可用于海产品保鲜 | |
| D. | 糖类、油脂、蛋白质、维生素、无机盐和水是人体所需的六大营养素 |
1.雷雨天闪电时空气中有臭氧生成,下列说法不正确的是( )
| A. | O2和O3的相互转化是物理变化 | |
| B. | O2和O3互为同素异形 | |
| C. | 等物质的量的O2和O3含有的质子数不相同 | |
| D. | 在相同的温度与压强下,等体积的O2和O3含有相同的分子数 |

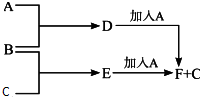 A、B、C为三种单质(其中A为固体,B、C为气体),D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色,B、C反应的产物易溶于水得到无色溶液E.它们之间的转化关系如图:
A、B、C为三种单质(其中A为固体,B、C为气体),D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色,B、C反应的产物易溶于水得到无色溶液E.它们之间的转化关系如图: