题目内容
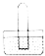
1.根据CO还原铁的氧化物的实验装置图(如图所示),回答下列问题:
(1)怎样知道硬质玻璃管中氧化铁已开始反应?红色粉末开始变成黑色;
(2)写出硬质玻璃管中发生反应的化学方程式:Fe2O3+3CO $\frac{\underline{\;高温\;}}{\;}$Fe+3CO2;
(3)在A处点燃,为什么要点燃?除去尾气中的一氧化碳,防止污染空气;
(4)实验结束时应注意的操作是④.
①先停止通入CO
②先熄灭酒精灯,并继续通入CO
③熄灭酒精灯,同时停止通入CO
④先熄灭酒精灯,继续通入CO至被还原的铁粉冷却,并点燃排出的CO气体.
分析 (1)红色氧化铁和一氧化碳反应生成还原性黑色固体铁;
(2)硬质玻璃管中发生反应是含碳还原氧化铁生成二氧化碳和铁;
(3)尾气中有未反应完的一氧化碳有毒,不能排放到空气中;
(4)CO还原铁的氧化物的实验的操作步骤和注意事项分析选项.
解答 解:(1)如果红色的粉末开始变成黑色,说明Fe2O3和CO开始反应了,
故答案为:红色粉末开始变成黑色;
(2)硬质玻璃管中发生反应是含碳还原氧化铁生成二氧化碳和铁,反应的化学方程式为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,
故答案为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
(3)因为尾气中有未反应完的一氧化碳有毒,跑到空气中会污染空气,所以点燃一氧化碳燃烧处理,
故答案为:除去尾气中的一氧化碳,防止污染空气;
(4)实验结束时应先熄灭加热Fe2O3的酒精灯,继续通入CO至被还原的铁粉冷却,否则还原出的铁又被空气中的氧气氧化,故选④,
故答案为;④.
点评 本题主要考查了化学方程式的书写、判断物质的方法和炼铁原理等方面的内容,可以依据已有的知识进行.

练习册系列答案
相关题目
11.如图是进行气体性质实验的常用装置,下列对有关实验现象的说法中,不正确的是( )

| A. | 若水槽中是水,试管中是CH4和Cl2,光照后可看到液面上升,有油状物产生 | |
| B. | 若水槽中是水(并滴有一定量酚酞),试管中是NH3可看到液面上升并呈红色 | |
| C. | 若水槽中是水,试管中是NO2,可看到试管中液面上升并充满整个试管 | |
| D. | 若水槽中和试管中都是氯水,光照后可在试管中收集到氧气 |
12.下列各组离子,在水溶液中可以大量共存的是( )
| A. | K+、H+、OH-、Cl- | B. | Ba2+、Na+、NO3-、CO32- | ||
| C. | Na+、H+、Cl-、SO42- | D. | Na+、Ag+、Cl-、SO42- |
9.NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 35.5g Cl2中含有共价键数为NA[M(Cl)=35.5g/mol] | |
| B. | 常温常压下,22.4L CCl4含有NA个CCl4分子 | |
| C. | 1mol乙炔中含有的电子数为10NA | |
| D. | 46g NO2和N2O4的混合气体中所含原子数为3NA |
16.现有下列符号:612C、613C、1123Na、1735Cl、11H、12H,它们共表示( )
| A. | 三种元素 | B. | 四种元素 | C. | 五种元素 | D. | 六种元素 |
6.“绿色化学”要求从经济、环保和技术上设计可行的化学反应.据此,由单质镁制硝酸镁的下列4个方案中,你认为可行而且符合“绿色化学”要求的方案是( )
| A. | Mg$\stackrel{浓HNO_{3}}{→}$Mg(NO3)2 | |
| B. | Mg$\stackrel{Cl_{2}}{→}$MgCl2$\stackrel{NaOH}{→}$Mg(OH)2$\stackrel{稀HNO_{3}}{→}$Mg(NO3)2 | |
| C. | Mg$\stackrel{O_{2}}{→}$MgO$\stackrel{稀HNO_{3}}{→}$Mg(NO3)2 | |
| D. | Mg$\stackrel{浓H_{2}SO_{4}}{→}$MgSO4$\stackrel{Ba(NO_{3})_{2}溶液}{→}$Mg(NO3)2 |
13.将某NaOH溶液分成两等份,一份敞口放置于空气中,另一份密闭保存,一段时间后,往上述两份溶液中分别加入足量同浓度的稀盐酸,充分反应,消耗盐酸的质量( )
| A. | 密闭保存的那份多 | B. | 敞口放置的那份多 | ||
| C. | 一样多 | D. | 无法比较 |