题目内容
11.为提纯下列物质(括号内为杂质),选用的试剂和分离方法都正确的是( )| 物质 | 试剂 | 分离方法 | |
| A | 硝酸钾(氯化钠) | 蒸馏水 | 降温结晶 |
| B | 二氧化碳(氯化氢) | 饱和碳酸钠溶液 | 洗气 |
| C | 乙醇(水) | 生石灰 | 蒸馏 |
| D | 氢氧化钠(氢氧化钡) | 稀硫酸 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二者溶解度受温度影响不同;
B.二者均与碳酸钠反应;
C.CaO与水反应后,增大与乙醇的沸点差异;
D.硫酸与氢氧化钡反应生成硫酸钡和水,但NaOH与硫酸反应.
解答 解:A.二者溶解度受温度影响不同,则溶于水,冷却结晶可分离,故A正确;
B.二者均与碳酸钠反应,不能除杂,应选饱和碳酸氢钠溶液除杂,故B错误;
C.CaO与水反应后,增大与乙醇的沸点差异,然后蒸馏可除杂,故C正确;
D.硫酸与氢氧化钡反应生成硫酸钡和水,但NaOH与硫酸反应,将原物质除去,不能除杂,故D错误;
故选AC.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的综合应用,题目难度不大.

练习册系列答案
相关题目
1.下列操作能达到实验目的且符合实验室安全措施的是( )
| A. | 稀释浓硫酸,应将水慢慢注入盛有浓硫酸的烧杯中并搅拌 | |
| B. | 酒精灯洒出的酒精万一在桌上着火,应立即用湿抹布扑盖 | |
| C. | 碱溶液沾到皮肤上,应尽快用抹布擦拭干净,再涂上稀盐酸 | |
| D. | 氢气还原氧化铜实验结束时,为节约氢气,应先停止氢气再停止加热 |
2.下列各组离子,能在溶液中大量共存的是( )
| A. | Na+、Al3+、OH-、Br- | B. | H+、Fe2+、SO42-、CO32- | ||
| C. | K+、NH4+、CO32-、OH- | D. | Ca2+、Al3+、NO3-、Cl- |
6.下列有关物质性质或应用的说法正确的是( )
| A. | 医疗上,常用碳酸钠治疗胃酸过多 | |
| B. | 在海轮外壳上安装锌块以减缓船体腐蚀 | |
| C. | 液氨汽化放出大量的热,可用作制冷剂 | |
| D. | 明矾具有强氧化性,常用于自来水的杀菌消毒 |
16.下列溶液中,跟100mL 0.8mol•L-1NaCl溶液所含的Cl-物质的量浓度相同的是( )
| A. | 100 mL 0.8 mol•L-1MgCl2溶液 | B. | 200 mL 0.4 mol•L-1AlCl3溶液 | ||
| C. | 50 mL 1.6 mol•L-1NaCl溶液 | D. | 25 mL 0.8 mol•L-1HCl溶液 |
3.下列说法中,不正确的是( )
| A. | 化学反应中既有物质变化又有能量变化 | |
| B. | 物质发生变化时,即使没有发生化学变化,也可能有能量的变化 | |
| C. | 任何化学反应中的能量变化都表现为放出热量或吸收热量 | |
| D. | 物质的化学能可以通过不同的变化方式转化为热能、电能等 |
1.海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品.
(1)海水中制得的氯化钠可用于生产烧碱及氯气.反应的离子方程式是2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-.
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
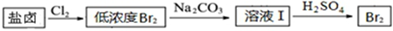
将Br2与Na2CO3反应的化学方程式补充完整:□Br2+□Na2CO3═NaBrO3+□5NaBr+□3CO2
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子.以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):
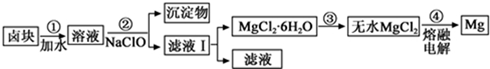
生成氢氧化物沉淀的pH
①步骤②中需控制pH=9.8,其目的是除去溶液中含有的Fe2+、Fe3+、Mn2+杂质,使之完全生成沉淀而除去.
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是ClO-+2Fe2++5H2O=2Fe(OH)3+Cl-+4H+.
③步骤③需在HCl保护气中加热进行,其原理涉及的离子方程式为Mg2++2H2O?Mg(OH)2+2H+.
④NaClO还能除去盐卤中的CO(NH2)2,生成盐类物质和能参与大气循环的物质.除去0.1mol CO(NH2)2时消耗NaClO22.35g.
(1)海水中制得的氯化钠可用于生产烧碱及氯气.反应的离子方程式是2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-.
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
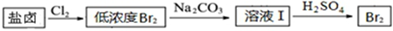
将Br2与Na2CO3反应的化学方程式补充完整:□Br2+□Na2CO3═NaBrO3+□5NaBr+□3CO2
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子.以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):

生成氢氧化物沉淀的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是ClO-+2Fe2++5H2O=2Fe(OH)3+Cl-+4H+.
③步骤③需在HCl保护气中加热进行,其原理涉及的离子方程式为Mg2++2H2O?Mg(OH)2+2H+.
④NaClO还能除去盐卤中的CO(NH2)2,生成盐类物质和能参与大气循环的物质.除去0.1mol CO(NH2)2时消耗NaClO22.35g.
 .
.