题目内容
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、标况下,11.2L的CHCl3含有分子数为0.5NA个 |
| B、常温下,14g乙烯和丙烯的混合物中总原子数为3NA个 |
| C、1mol苯乙烯中含有的碳碳双键数为4NA个 |
| D、0.1mol CnH2n+2中含有的碳碳单键数为0.1nNA个 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、标准状况下,三氯甲烷不是气体,不能使用标况下的气体摩尔体积计算三氯甲烷的物质的量;
B、乙烯和丙烯的最简式为CH2,14g混合物中含有1mol最简式;
C、苯乙烯分子中,苯环不含碳碳双键,1mol苯乙烯中含有1mol碳碳双键;
D、CnH2n+2为烷烃,0.1mol CnH2n+2中含有0.1(n-1)mol碳碳单键.
B、乙烯和丙烯的最简式为CH2,14g混合物中含有1mol最简式;
C、苯乙烯分子中,苯环不含碳碳双键,1mol苯乙烯中含有1mol碳碳双键;
D、CnH2n+2为烷烃,0.1mol CnH2n+2中含有0.1(n-1)mol碳碳单键.
解答:
解:A、标况下,三氯甲烷不是气体,题中条件无法计算三氯甲烷的物质的量,故A错误;
B、14g乙烯和丙烯的混合物中含有1mol最简式为CH2,含有1molC、2molH,总共含有3mol原子,总原子数为3NA个,故B正确;
C、苯环中的碳碳键为独特键,不存在碳碳双键,所以1mol苯乙烯中含有1mol碳碳双键,含有的碳碳双键数为NA个,故C错误;
D、0.1mol CnH2n+2中含有0.1(n-1)mol碳碳单键,含有的碳碳单键数为0.1(n-1)NA个,故D错误;
故选B.
B、14g乙烯和丙烯的混合物中含有1mol最简式为CH2,含有1molC、2molH,总共含有3mol原子,总原子数为3NA个,故B正确;
C、苯环中的碳碳键为独特键,不存在碳碳双键,所以1mol苯乙烯中含有1mol碳碳双键,含有的碳碳双键数为NA个,故C错误;
D、0.1mol CnH2n+2中含有0.1(n-1)mol碳碳单键,含有的碳碳单键数为0.1(n-1)NA个,故D错误;
故选B.
点评:本题考查阿伏伽德罗常数的判断及计算,题目难度中等,注意明确标况下气体摩尔体积的使用条件,熟练掌握阿伏伽德罗常数与物质的量等物理量之间的转化,选项B为难点和易错点,注意利用最简式计算混合物中含有的原子数.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案
相关题目
下列各组物质中互为同分异构体的是( )
| A、C3H8和C6H14 |
B、CH3COOH和 |
| C、O2和O3 |
D、CH3-CH2-CH3和 |
 如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )| A、R和Z形成的化合物属于共价化合物 |
| B、Y单质能在X的单质中燃烧,生成淡黄色物质Y2X2 |
| C、X、Z形成的化合物化学式为Z2X3,它属碱性氧化物 |
| D、在常温下,Z单质能溶于W的最高价氧化物对应水化物浓溶液中,生成氢气 |
X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标况下的密度为0.76g?L-1;W的质子数是X、Y、Z、M四种元素质子数之和的
.下列说法正确的是( )
| 1 |
| 2 |
| A、由X、Y、Z、M四种元素形成的化合物一定有共价键 |
| B、原子半径:W>Z>Y>X>M |
| C、由X元素形成的单质一定是原子晶体 |
| D、XZ2、X2M2、W2Z2均为直线型的共价化合物 |
下列表示对应化学反应的离子方程式正确的是( )
| A、氯化铵固体与消石灰反应制备氨气:NH4++OH-=NH3↑+H2O | ||||
B、用石墨棒作电极电解饱和食盐水:Cl-+Na+
| ||||
| C、硫酸铝溶液与过量氨水反应的离子方程式:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ | ||||
| D、用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O |
短周期元素W、X、Y和Z的原子序数依次增大,元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍.下列说法错诶的是( )
| A、元素X与氢形成原子个数比为1:1的化合物有多种 |
| B、元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 |
| C、Z的原子半径比Y的原子半径大 |
| D、元素Z可与元素X形成共价化合物XZ2,且各微粒均满足8电子的稳定结构 |

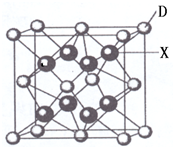 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素.化合物DC2的晶体为离子晶体,其阳离子与阴离子的个数比为1:1,D的二价阳离子比C的简单阴离子多一个电子层.AC2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E原子序数为26.回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示).
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素.化合物DC2的晶体为离子晶体,其阳离子与阴离子的个数比为1:1,D的二价阳离子比C的简单阴离子多一个电子层.AC2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E原子序数为26.回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示).