题目内容
2.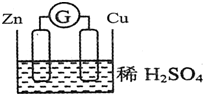 请观察如图装置,回答下列问题:
请观察如图装置,回答下列问题:①负极是Zn,发生氧化反应(填氧化或还原)
②正极的电极反应式:2H++2e-=H2↑
③该装置是一种把化学能转变为电能的装置,当导线中有0.2mol e-发生转移时,求参加氧化反应的物质的物质的量为0.1mol.
分析 该装置为原电池,将化学能转变为电能,Zn易失电子发生氧化反应作负极、Cu得电子发生还原反应作正极,负极上电极反应式为Zn-2e-=Zn2+、正极反应式为2H++2e-=H2↑,根据两极得失电子总数相等进行计算.
解答 解:①该装置为原电池,将化学能转变为电能,Zn易失电子发生氧化反应作负极、Cu得电子发生还原反应作正极,负极上电极反应式为Zn-2e-=Zn2+、正极反应式为2H++2e-=H2↑,故答案为:Zn;氧化;
②正极上氢离子得电子生成氢气,反应式为2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
③该装置为原电池,将化学能转变为电能,负极上锌失去电子发生氧化反应,电极反应式为Zn-2e-=Zn2+,当导线中有0.2mol e-发生转移时,参加氧化反应的锌的物质的量为0.1mol,故答案为:化学能转变为电能; 0.1mol.
点评 本题考查了原电池原理,明确正负极上发生的反应即可解答,根据电极反应式进行计算,题目难度不大.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
12.下列关于化学反应的速率和限度的说法错误的是( )
| A. | 化学反应速率通过用单位时间里反应物浓度或生成物浓度的变化量表示 | |
| B. | 化学平衡状态指的是在一定条件下反应物和生成物浓度不再改变时的状态 | |
| C. | 决定化学反应速率的主要因素是温度 | |
| D. | 催化剂只能加快化学反应速率,不能提高原料利用率和转化率 |
13.下列各项中表达正确的是( )
| A. | 第VⅡA族元素形成的氢化物中沸点最高的是HI | |
| B. | 水分子很稳定性是因为水分子间易形成氢键 | |
| C. | 二氧化碳电子式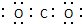 | |
| D. | 第三周期元素形成的简单离子中,半径最小的是Al3+ |
10.锗酸铋(简称BGO)是我国研制成功的一种性能优良的闪烁晶体材料,其中锗(Ge与碳同主族)元素处于最高价态,铋元素(Bi与氮同主族)的价态与它跟氯形成某种共价氯化物所呈的价态相同,且此氯化物中铋具有8电子稳定结构.BGO的化学式是( )
| A. | Bi3Ge3O15 | B. | Bi4Ge3O12 | C. | Bi4Ge3O16 | D. | Bi3Ge3O12 |
17.下列叙述正确的是( )
| A. | 鉴定蔗糖水解产物中有葡萄糖:直接在水解液中加入新制Cu(OH)2 | |
| B. | 医学上常用新制的Cu(OH)2悬浊液检验尿液中的葡萄糖 | |
| C. | 工业上利用油脂在酸的催化作用下发生水解来生产肥皂 | |
| D. | 向蛋白质溶液中加入浓的Na2SO4或CuSO4溶液均可使蛋白质盐析而分离提纯 |
6.下列方程式书写正确的是( )
| A. | 向Na2SiO3溶液中通入过量的CO2:SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3- | |
| B. | 常温下,铁和稀硝酸反应:2Fe+6HNO3═2Fe(NO3)3+3H2↑ | |
| C. | 碳酸氢钠和过量稀盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| D. | 铜和浓硫酸加热反应:Cu+4H++SO42-$\frac{\underline{\;\;△\;\;}}{\;}$ Cu2++SO2↑+2H2O |
7.在气体反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是( )
①增大反应物的浓度
②升高温度
③增大压强
④移去生成物
⑤加入催化剂.
①增大反应物的浓度
②升高温度
③增大压强
④移去生成物
⑤加入催化剂.
| A. | ①③⑤ | B. | ②③⑤ | C. | ②⑤ | D. | ①③④ |
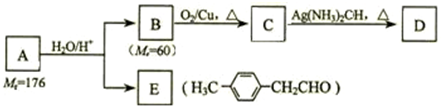
 .
. 、
、 、
、 (其中一种).
(其中一种).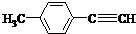 )的一条路线如下:
)的一条路线如下: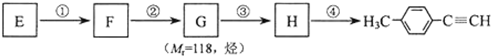
 ;
;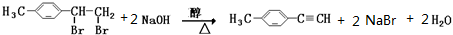 .
.