题目内容
16.化学与生产、生活、环境等社会实际密切相关.下列叙述正确的是( )| A. | “滴水石穿、绳锯木断”一定不涉及化学变化 | |
| B. | 明矾净水的原理和“84”消毒液消毒的原理不相同 | |
| C. | 充分开发利用天然纤维,停止使用各种化学合成材料 | |
| D. | 食品包装袋中常放入小袋的生石灰,目的是防止食品氧化变质 |
分析 A.水中溶解的二氧化碳与碳酸钙反应生成碳酸氢钙;
B.明矾净水是利用胶体的吸附性,“84”消毒液消毒是利用物质的强氧化性;
C.化学合成材料对造福人类作出了积极的贡献;
D.生石灰用作干燥剂.
解答 解:A.水中溶解的二氧化碳与碳酸钙反应生成碳酸氢钙,所以滴水石穿过程中涉及化学变化,故A错误;
B.明矾水解生成氢氧化铝胶体,胶体具有吸附性而吸附水中的杂质,所以能净水,“84”消毒液中含有次氯酸盐,具有强氧化性,能杀菌消毒,所以明矾净水的原理和“84”消毒液消毒的原理不同,故B正确;
C.各种化学合成材料在生产生活中应用广泛,有很多优良的性质,天然纤维不能代替合成材料,故C错误;
D.生石灰用作干燥剂,食品包装袋中常放入小袋的生石灰,目的是防止食品吸水,故D错误.
故选B.
点评 本题考查了化学变化、净水原理、合成材料、干燥剂,侧重于考查化学知识在生产生活中的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.将c mol•L-1的AlCl3溶液V1 mL加水稀释至V2 mL,稀释后溶液中Cl-物质的量浓度为( )
| A. | $\frac{{V}_{1}}{{V}_{2}}$c mol•L-1 | B. | $\frac{{V}_{1}}{{V}_{2}}$c mol•L-1 | ||
| C. | $\frac{{3V}_{2}}{{V}_{1}}$c mol•L-1 | D. | $\frac{3{V}_{1}}{{V}_{2}}$c mol•L-1 |
7.已知强酸可制弱酸.下图为证明HCl、H2CO3、H2SiO3的酸性强弱的装置,其中说法不正确的是( )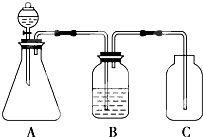

| A. | A中的化学反应可能为:CaCO3+2HCl═CO2↑+CaCl2+H2O | |
| B. | 装置B中盛放的试剂为Na2CO3溶液 | |
| C. | 装置C中盛放的为可溶性硅酸盐 | |
| D. | 由此实验可得到的结构是:酸性HCl>H2CO3>H2SiO3 |
4.莫尔盐[(NH4)2Fe(SO4)2•6H2O]常作氧化还原滴定法的基准物质,下列有关该盐溶液的比较,不正确的是( )
| A. | c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) | B. | c(SO42-)=c(NH4+)>c(Fe2+)>c(H+)>c(OH-) | ||
| C. | 2c(SO42-)+c(OH-)=c(NH4+)+2c(Fe2+)+c(H+) | D. | c(NH4+)+c(NH3•H2O)=2c(Fe2+)+2c[Fe(OH)2] |
11.四种常见元素的性质或结构信息如表所示,请问答下列问题.
(1)R的基态原子价层电子排布式为3d104s1,A、B、D这三种元素的第一电离能由大到小的顺序为N>C>Si(写元素符号).
(2)A、B,D均可形成多种氢化物,在最常见的三种氢化物中,分子构型为三角锥的氢化物分子式为NH3,任意写出一种中心原子存在sp2、sp3两种杂化类型的物质的结构简式CH2=CH-CH3,与A的常见单质互为等电子体的上述元素的氧化物是CO.
(3)B、D均可形成氧化物,等物质的量的B、D的最高价氧化物中σ键之比为2:1,已知有下列两种数据:
两种氧化物熔点、沸点差异过大,请用键能大小解释CO2是分子晶体,熔点、沸点高低是由比较微弱的范德华力决定的而与化学键强弱无关,SiO2属原子晶体,其熔点、沸点高低是由强大的共价键决定的.
(4)在一定条件下,Cl-与R2+可形成一种无限长链离 ,研究表明该离子中每个氯原子最外层均达到8电子稳定结构,有些氯与R之间存在配位键,若该长链离子中含有n个R,则该离子的化学式为$(CuC{l}_{3}{)_{n}}^{n-}$.
,研究表明该离子中每个氯原子最外层均达到8电子稳定结构,有些氯与R之间存在配位键,若该长链离子中含有n个R,则该离子的化学式为$(CuC{l}_{3}{)_{n}}^{n-}$.
(5)A元素能形成组成为Pt(AH3)2Cl2 的配合物,该配合物存在两种同分异构体:一种为淡黄色(Q),不具有抗癌作用,在水中的溶解度小;另一种为黄绿色(P),具有抗癌作用,在水中的溶解度较大.
①Q是非极性分子(填“极性”或“非极性”)分子,
②P的结构简式为 ( AH3配体作为一个整体写).
( AH3配体作为一个整体写).
| 元素 | A | B | R | D |
| 相关信息 | 基态原子核外电子占据3个能级且最高能级上有3个电子 | B的单质是最常见半导体材料 | 位于第四周期I B族 | 是非金属元素,其形成的某种单质是电的良导体,有的分子形状似足球 |
(2)A、B,D均可形成多种氢化物,在最常见的三种氢化物中,分子构型为三角锥的氢化物分子式为NH3,任意写出一种中心原子存在sp2、sp3两种杂化类型的物质的结构简式CH2=CH-CH3,与A的常见单质互为等电子体的上述元素的氧化物是CO.
(3)B、D均可形成氧化物,等物质的量的B、D的最高价氧化物中σ键之比为2:1,已知有下列两种数据:
| 键能(kJ/mol) | 熔点(K) | 沸点(K) | |
| BO2 | B-O:452 | 1923 | 2503 |
| DO2 | D=O:615,D-O:348 | 216 | 195 |
(4)在一定条件下,Cl-与R2+可形成一种无限长链离
 ,研究表明该离子中每个氯原子最外层均达到8电子稳定结构,有些氯与R之间存在配位键,若该长链离子中含有n个R,则该离子的化学式为$(CuC{l}_{3}{)_{n}}^{n-}$.
,研究表明该离子中每个氯原子最外层均达到8电子稳定结构,有些氯与R之间存在配位键,若该长链离子中含有n个R,则该离子的化学式为$(CuC{l}_{3}{)_{n}}^{n-}$.(5)A元素能形成组成为Pt(AH3)2Cl2 的配合物,该配合物存在两种同分异构体:一种为淡黄色(Q),不具有抗癌作用,在水中的溶解度小;另一种为黄绿色(P),具有抗癌作用,在水中的溶解度较大.
①Q是非极性分子(填“极性”或“非极性”)分子,
②P的结构简式为
 ( AH3配体作为一个整体写).
( AH3配体作为一个整体写).
8.下列溶液中粒子的物质的量浓度关系正确的是( )
| A. | 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| B. | 20mL 0.1mol/L CH3COONa溶液与10mL 0.1mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-) | |
| D. | 0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
5.已知在448℃时,反应H2(g)+I2(g)?2HI(g)的平衡常数为49.下列叙述中正确的是(相同温度下)( )
| A. | 反应H2(g)+I2(g)?2HI(g)的平衡常数K=$\frac{c(HI)}{c({H}_{2})c({I}_{2})}$=49 | |
| B. | 反应2HI(g)?H2(g)+I2(g)的平衡常数K=$\frac{c({H}_{2})c({I}_{2})}{{c}^{2}(HI)}$=49 | |
| C. | 反应HI(g)?$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(g)的平衡常数K=$\frac{c({H}_{2})c({I}_{2})}{{c}^{2}(HI)}$=7 | |
| D. | 反应2HI(g)?H2(g)+I2(g)的平衡常数K=$\frac{c({H}_{2})c({I}_{2})}{{c}^{2}(HI)}$=$\frac{1}{49}$ |
 太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、锎、硼、镓、硒等.回答下列问題:
太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、锎、硼、镓、硒等.回答下列问題: