题目内容
1.某NaCl样品中混有NaBr杂质,为了测定该NaCl样品的纯度,设计的实验过程如图所示:
阅读上述实验过程,完成下列填空:
(1)如图1装置是用来完成向溶液甲中通入过量Cl2的实验,在图2内填写装置中所放的化学药品.
(2)萃取所需要的主要玻璃仪器是分液漏斗;
(3)溶液甲中通入Cl2的化学方程式为2NaBr+Cl2=2NaCl+Br2;
(4)原固体样品中氯化钠的质量分数为90%.

分析 (1)氯气的制取选用二氧化锰和浓盐酸,饱和食盐水除去氯化氢,通气体选用C装置,过量的氯气用氢氧化钠除去;
(2)萃取实验的主要玻璃仪器是分液漏斗;
(3)溶液甲为混有溴化钠的氯化钠溶液,通入氯气后,氯气可以置换出溴化钠中的溴;
(4)根据反应前后固体质量差,结合反应方程式用差量法进行计算.
解答 解:(1)氯气的制取选用二氧化锰和浓盐酸,故A装置中所放的化学药品为二氧化锰和浓盐酸,用饱和食盐水除去氯化氢,故B装置中所放的化学药品为饱和食盐水,反应中过量的氯气用氢氧化钠除去,所以D装置中的试剂为氢氧化钠溶液,
故答案为:二氧化锰和浓盐酸;饱和食盐水;氢氧化钠溶液;
(2)萃取实验的主要玻璃仪器是分液漏斗,
故答案为:分液漏斗;
(3)溶液甲为混有溴化钠的氯化钠溶液,通入氯气后,氯气可以置换出溴化钠中的溴,反应的化学方程式为2NaBr+Cl2=2NaCl+Br2,
故答案为:2NaBr+Cl2=2NaCl+Br2;
(4)设样品中溴化钠的质量为xg,2NaBr+Cl2=2NaCl+Br2 △m
206 117 89
x 44-42.1=1.9
$\frac{206}{x}$=$\frac{89}{1.9}$,x=4.4,故原固体混合物中氯化钠的质量分数为:$\frac{44.0-4.4}{44.0}$×100%=90.0%,
故答案为:90.0%.
点评 本题是关于食盐样品的纯度的综合题,对学生分析和解决问题的能力要求较高,难度较大,注意用差量法进行计算.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
15.不锈钢表面用硝酸和氢氟酸的混酸处理后,产生的酸洗废液中含有Fe3+、Ni2+、NO3-、F-和+6价铬的含氧酸根离子等.如图是综合利用该酸洗废液的工艺流程:
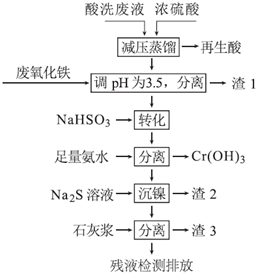
已知:
①金属离子开始沉淀和沉淀完全时的pH:
②Ni2+与足量氨水的反应为:Ni2++6NH3?[Ni(NH3)6]2+
(1)再生酸中含有硝酸、氢氟酸,采取减压蒸馏的原因是降低蒸馏的温度以减少硝酸的分解.
(2)利用废氧化铁(主要成分为Fe2O3)代替烧碱调节pH的好处是实现废物利用,降低生产成本.
(3)请写出“转化”时NaHSO3与Cr2O72-发生反应的离子反应方程式:Cr2O72-+3HSO3-+5H+=2Cr3++3SO42-+4H2O.
(4)已知[Ni(NH3)6]2+为难电离的络合离子,则“沉镍”的离子方程式为:[Ni(NH3)6]2++S2-=NiS↓+6NH3.
(5)滤渣3的主要成分为CaF2、Ca(OH)2和CaSO4.
(6)经检测,最后的残液中c(Ca2+)=0.004mol•L-1,则残液中F-浓度为1.9mg•L-1,符合(填“符合”或“不符合”)排放标准[已知Ksp(CaF2)=4×10-11 mol3•L-3,国家排放标准要求氟离子浓度小于10mg•L-1].

已知:
①金属离子开始沉淀和沉淀完全时的pH:
| Fe3+ | Ni2+ | Cr3+ | |
| 开始沉淀 | 1.5 | 6.7 | 4.0 |
| 沉淀完全 | 3.4 | 9.5 | 6.9 |
(1)再生酸中含有硝酸、氢氟酸,采取减压蒸馏的原因是降低蒸馏的温度以减少硝酸的分解.
(2)利用废氧化铁(主要成分为Fe2O3)代替烧碱调节pH的好处是实现废物利用,降低生产成本.
(3)请写出“转化”时NaHSO3与Cr2O72-发生反应的离子反应方程式:Cr2O72-+3HSO3-+5H+=2Cr3++3SO42-+4H2O.
(4)已知[Ni(NH3)6]2+为难电离的络合离子,则“沉镍”的离子方程式为:[Ni(NH3)6]2++S2-=NiS↓+6NH3.
(5)滤渣3的主要成分为CaF2、Ca(OH)2和CaSO4.
(6)经检测,最后的残液中c(Ca2+)=0.004mol•L-1,则残液中F-浓度为1.9mg•L-1,符合(填“符合”或“不符合”)排放标准[已知Ksp(CaF2)=4×10-11 mol3•L-3,国家排放标准要求氟离子浓度小于10mg•L-1].
12.两种短周期元素X、Y,其原子核外电子层数分别为a、b,最外层电子数分别为m、n.下列说法不正确的是( )
| A. | 若3<m<8,则X必定为主族元素 | |
| B. | 若a<b且m=n=4,X、Y不可能形成化合物 | |
| C. | Y的气态氢化物的分子式为H8-nY | |
| D. | 若a=b=3,8>m>n>5,则元素非金属性:X>Y |
19.下表中的数据表示破坏1mol化学键消需耗的能量:根据下表数据计算以下反应生成1molCO2时的热量变化( )CH4(g)+2O2(g)$\frac{\underline{\;点燃\;}}{\;}$CO2(g)+2H2O(g)
| 化学键 | C-H | O-O | O=O | C-0 | C=O | H-O |
| 能量(KJ) | 415 | 138 | 498 | 343 | 798 | 465 |
| A. | 放出热量800kJ | B. | 放出热量1520kJ | C. | 吸收热量410kJ | D. | 放出热量610kJ |
6.下列转化关系不能通过一步反应直接完成的是( )
| A. | Cu→CuCl2 | B. | CuO→Cu2O | C. | Cu(OH)2→CuO | D. | CuO→Cu(OH)2 |
13.图中a、b、c、d、e、f表示元素周期表中部分短周期元素,下列叙述正确的是( )


| A. | a、b、c的简单离子中,b的离子半径最大 | |
| B. | c、d、f最高价氧化物对应的水化物两两之间均可发生反应 | |
| C. | e的氢化物比f的氢化物的稳定性高 | |
| D. | 离子半径a3-小于d3+ |
10.最近,中国科大的科学家们将C60分子组装在一单层分子膜表面,在-268℃时冻结分子的热振荡,并利用扫描隧道显微镜首次“拍摄”到能清楚分辨碳原子间单、双键的分子图象.下列化合物分子中一定既含σ键又含π键的是( )
| A. | CO2 | B. | COCl2 | C. | C2H6O | D. | H2O2 |
11.氯气和漂白粉是现代工业和生活中常用的消毒液、杀菌剂.
(1)写出工业上用氯气和石灰乳制取漂白粉的化学方程式2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O
(2)实验室有一瓶密封不严的漂白粉样品,其中一定含有CaCl2、Ca(OH)2,请设计实验,探究该样品中可能存在的其它固体物质
①提出合理假设
假设1:该漂白粉未变质,含Ca(ClO)2
假设2:该漂白粉全部变质,含CaCO3
假设3:该漂白粉部分变质,则含有CaCO3和Ca(ClO)3
②设计实验方案,进行实验,并完成实验报告.
(1)写出工业上用氯气和石灰乳制取漂白粉的化学方程式2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O
(2)实验室有一瓶密封不严的漂白粉样品,其中一定含有CaCl2、Ca(OH)2,请设计实验,探究该样品中可能存在的其它固体物质
①提出合理假设
假设1:该漂白粉未变质,含Ca(ClO)2
假设2:该漂白粉全部变质,含CaCO3
假设3:该漂白粉部分变质,则含有CaCO3和Ca(ClO)3
②设计实验方案,进行实验,并完成实验报告.
| 实验步骤 | 预期现象和结论 | |
| ① | 取样品于试管中,加入适量2.0mol•L-1盐酸溶解后,再将产生的气体经蒸馏水、四氯化碳后导入澄清石灰水中 | a.若澄清石灰水未见浑浊,则假设1成立 b.若澄清石灰水变浑浊,则假设2或3成立 |
| ② | 取样品于试管中,加入适量2.0mol•L-1盐酸溶解后,再向试管中滴入1-2滴品红溶液,振荡 | 若品红褪色,结合实验①中的现象和结论b,则假设3 成立 |
 (主要产物),1mol某烃A充分燃烧后得到8mol CO2和4mol H2O.
(主要产物),1mol某烃A充分燃烧后得到8mol CO2和4mol H2O.
 .
.
 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$ +NaBr
+NaBr +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaBr+2H2O.
+2NaBr+2H2O.