题目内容
A、B、C、D、E、F是短周期元素,周期表中A与B、B与C相邻;C与E同主族;A与C最外层电子数之比为2:3,B的最外层电子数比C的最外层电子数少1个; F元素的原子在周期表中半径最小;常见化合物D2C2与水反应生成C的单质,且溶液使酚酞溶液变红.
(1)E在周期表中的位置为 ;D的最高价氧化物的水化物的电子式 .
(2)B、C的氢化物稳定性顺序为(用分子式表示,由大到小) > .
(3)B的氢化物和B的最高价氧化物的水化物反应生成Z,则Z的名称为 ,Z的化学键类型为 .
(4)两种均含C、D、E、F四种元素的化合物相互反应放出气体的反应离子方程式为 .
(5)一定量的D2C2与AC2反应后的固体物质,恰好与含0.8mol HCl的稀盐酸完全反应,并收集0.35mol 气体,则固体物质的组成为(写清成分和物质的量) .
(1)E在周期表中的位置为
(2)B、C的氢化物稳定性顺序为(用分子式表示,由大到小)
(3)B的氢化物和B的最高价氧化物的水化物反应生成Z,则Z的名称为
(4)两种均含C、D、E、F四种元素的化合物相互反应放出气体的反应离子方程式为
(5)一定量的D2C2与AC2反应后的固体物质,恰好与含0.8mol HCl的稀盐酸完全反应,并收集0.35mol 气体,则固体物质的组成为(写清成分和物质的量)
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:根据常见化合物D2C2与水反应生成C的单质,且溶液使酚酞试液变红,可知C为O元素,D为Na元素,B的最外层电子数比C的最外层电子数少1个,则B的最外层电子数为5,且相邻,应为N元素,C与E同主族,E应为S元素,A与B相邻,A与E的最外层电子数之比2:3,则A的最外层电子数为4,应为C元素,F元素的原子在周期表中半径最小,F应为H元素,据此答题.
解答:
解:根据常见化合物D2C2与水反应生成C的单质,且溶液使酚酞试液变红,可知C为O元素,D为Na元素,B的最外层电子数比C的最外层电子数少1个,则B的最外层电子数为5,且相邻,应为N元素,C与E同主族,E应为S元素,A与B相邻,A与E的最外层电子数之比2:3,则A的最外层电子数为4,应为C元素,F元素的原子在周期表中半径最小,F应为H元素,
(1)E为S元素,在周期表中第三周期第ⅥA族,钠的最高价氧化物对应的水化物为NaOH,它的电子式为 ,
,
故答案为:第三周期第ⅥA族; ;
;
(2)B、C分别为N、O元素,同一周期元素从左到右元素的非金属性逐渐增强,对应的氢化物的稳定性逐渐增大,所以B、C的氢化物稳定性由强到弱的顺序为H2O>NH3,
故答案为:H2O;NH3;
(3)B为氮元素,所以B的氢化物和B的最高价氧化物的水化物反应生成Z,Z为NH4NO3,名称为硝酸铵,是离子化合物,在铵根离子与硝酸根离子之间是离子键,在铵根离子和硝酸根离子内部都有极性键,
故答案为:硝酸铵;离子键、极性键;
(4)C、D、E、F四种元素的两种化合物相互间发生反应,且生成气体,两种化合物为NaHSO3、NaHSO4,在溶液中发生反应的离子方程式为 HSO3-+H+=SO2↑+H2O.
故答案为:HSO3-+H+=SO2↑+H2O;
(5)由2Na2O2+2CO2═2Na2CO3+O2、Na2CO3+2HCl═2NaCl+CO2↑+H20、2Na2O2+4HCl═4NaCl+O2↑+2H20,
反应后的固体物质,恰好与0.8mol稀盐酸溶液完全反应,并收集到0.25mol气体,
设反应后Na2CO3、Na2O2的物质的量分别为x、y,
则
,解得x=0.1mol,y=0.3mol,
即该固体物质的组成为0.1molNa2CO3和0.3molNa2O2,
故答案为:0.1molNa2CO3,0.3molNa2O2.
(1)E为S元素,在周期表中第三周期第ⅥA族,钠的最高价氧化物对应的水化物为NaOH,它的电子式为
 ,
,故答案为:第三周期第ⅥA族;
 ;
;(2)B、C分别为N、O元素,同一周期元素从左到右元素的非金属性逐渐增强,对应的氢化物的稳定性逐渐增大,所以B、C的氢化物稳定性由强到弱的顺序为H2O>NH3,
故答案为:H2O;NH3;
(3)B为氮元素,所以B的氢化物和B的最高价氧化物的水化物反应生成Z,Z为NH4NO3,名称为硝酸铵,是离子化合物,在铵根离子与硝酸根离子之间是离子键,在铵根离子和硝酸根离子内部都有极性键,
故答案为:硝酸铵;离子键、极性键;
(4)C、D、E、F四种元素的两种化合物相互间发生反应,且生成气体,两种化合物为NaHSO3、NaHSO4,在溶液中发生反应的离子方程式为 HSO3-+H+=SO2↑+H2O.
故答案为:HSO3-+H+=SO2↑+H2O;
(5)由2Na2O2+2CO2═2Na2CO3+O2、Na2CO3+2HCl═2NaCl+CO2↑+H20、2Na2O2+4HCl═4NaCl+O2↑+2H20,
反应后的固体物质,恰好与0.8mol稀盐酸溶液完全反应,并收集到0.25mol气体,
设反应后Na2CO3、Na2O2的物质的量分别为x、y,
则
|
即该固体物质的组成为0.1molNa2CO3和0.3molNa2O2,
故答案为:0.1molNa2CO3,0.3molNa2O2.
点评:本题主要考查了电子式、元素周期律、化学键、离子反应、根据化学方程式的计算等知识点,中等难度,解题的关键在于根据元素的性质确定元素种类,第(4)小问计算时注意化学计算的基本方法的运用.

练习册系列答案
相关题目
下列各组离子,能在强碱性溶液中大量共存的是( )
| A、K+、MnO4-、Mg2+、Cl- |
| B、Na+、Ba2+、HCO3-、NO3- |
| C、Na+、NO3-、CO32-、Cl- |
| D、K+、H+、Cl-、S2- |
如图所示,由锌片、铜片和稀硫酸溶液构成的原电池中,下列叙述正确的是( )
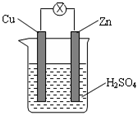

| A、锌片为负极,发生还原反应 |
| B、电流从锌片流向铜片 |
| C、一段时间后,铜片质量减轻 |
| D、一段时间后,溶液pH值变大 |
对于白磷引起的中毒,硫酸铜溶液是一种解毒剂,有关反应如下:11P+15CuSO4+24H2O═5Cu3P+6H3PO4+15H2SO4下列关于该反应的说法正确的是( )
| A、CuSO4发生了氧化反应 |
| B、生成1 mol H3PO4时,有10 mol 电子转移 |
| C、白磷只作还原剂 |
| D、氧化产物和还原产物的物质的量之比为6:5 |
下列各溶液中,Na+浓度最大的是( )
| A、0.8L 0.4mol/L的NaOH溶液 |
| B、0.1L 0.5mol/L的NaCl溶液 |
| C、1L 0.3mol/L的NaCl溶液 |
| D、0.2L0.25mol/L的Na3PO4溶液 |
下列表示对应化学反应的离子方程式正确的是( )
A、电解饱和NaCl溶液:2Cl-+2H+
| ||||
| B、向Na2SO3溶液中滴加足量NaClO溶液:SO32-+ClO-=SO42-+Cl- | ||||
| C、向FeBr2溶液中通入足量Cl2:2Fe2++Cl2=2Fe3++2Cl- | ||||
| D、向Ca(OH)2溶液中加少量NaHCO3溶液:2 HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
下列分散系不能发生丁达尔现象的是( )
| A、豆浆 | B、牛奶 | C、蔗糖溶液 | D、雾 |