题目内容
6.为应对环境污染,使得对如何减少煤燃烧和汽车尾气中各种含碳、氮、硫等气体的排放,及有效地开发利用碳资源的研究显得更加紧迫.(1)为减少煤燃烧中废气的排放,常将煤转化为清洁气体燃料.请写出焦炭与水蒸气高温下反应的化学方程式:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.
(2)选择适当的催化剂在高温下可将汽车尾气中的 CO、NO转化为无毒气体.
已知:①2CO(g)+O2(g)═2CO2(g)△H1=-566kJ?mol-1
②2NO(g)+2CO(g)?N2(g)+2CO2(g)△H2=-746kJ?mol-1
则反应N2(g)+O2(g)═2NO(g)的△H=+180kJ?mol-1.
(3)在一定温度下,向1L密闭容器中充入0.5mol NO、2mol CO,发生上述反应②,20s反应达平衡,此时CO的物质的量为1.6mol.在该温度下反应的平衡常数K=1.25.
(4)NO2会污染环境,可用NaOH溶液吸收NO2并生成等量的NaNO3和NaNO2.此反应的离子方程式是2NO2+2OH-=NO3-+NO2-+H2O;恰好反应后,所得溶液呈弱碱性,则溶液中离子浓度大小关系是 c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+)..
分析 (1)根据质量和原子守恒,焦炭与水蒸气高温下反应生成两种可燃性气体,据此书写方程式;
(2)据热化学方程式和盖斯定律计算;
(3)结合平衡三段式列式计算平衡浓度,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积得到;
(4)反应中只有N元素化合价变化,则N的化合价分别由+4价变化为+5价和+3价,根据转移电子书写离子方程式,生成等量的NaNO3和NaNO2,二者浓度相等,NO2-水解溶液呈碱性.
解答 解:(1)根据质量和原子守恒,焦炭与水蒸气高温下反应生成两种可燃性气体为CO和H2,则反应的方程式为:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2,
故答案为:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2;
(2)①2CO(g)+O2(g)=2CO2(g)△H1=-566kJ?mol-1
②2NO(g)+2CO(g)?N2(g)+2CO2(g)△H2=-746kJ?mol-1
依据盖斯定律计算①-②得到反应的热化学方程式为:N2(g)+O2(g)=2NO(g),△H=(-566+746)=+180KJ/mol,
故答案为:+180;
(3)在一定温度下,向1L密闭容器中充入0.5mol NO、2mol CO,发生上述反应②,20S反应达平衡,此时CO的物质的量为1.6mol,依据化学平衡三段式列式计算:
2NO(g)+2CO(g)?N2(g)+2CO2(g)
起始量(mol) 0.5 2 0 0
变化量(mol) 0.4 0.4 0.2 0.4
平衡量(mol) 0.1 1.6 0.2 0.4
体积为1L,物质的量数值为浓度数值,计算得到平衡常数K=$\frac{0.2×0.{4}^{2}}{0.{1}^{2}×1.{6}^{2}}$=1.25;
故答案为:1.25;
(4)用NaOH溶液吸收NO2,反应中只有N元素化合价变化,则N的化合价分别由+4价变化为+5价和+3价,转移电子1mol,生成等量的NaNO3和NaNO2,反应的离子方程式为:2NO2+2OH-=NO3-+NO2-+H2O,二者浓度相等,NO2-水解溶液呈碱性,所得溶液中的离子浓度大小关系为c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+),
故答案为:2NO2+2OH-=NO3-+NO2-+H2O;c(NO3-)>c(NO2-)>c(OH-)>c(H+).
点评 本题考查了热化学方程式的书写方法、盖斯定律计算、化学平衡常数的计算、离子浓度大小比较等,是对学生综合能力的考查,题目难度中等.

| A. |  $\underset{\stackrel{浓{H}_{2}S{O}_{4}}{→}}{50~60℃}$ $\underset{\stackrel{浓{H}_{2}S{O}_{4}}{→}}{50~60℃}$ | |
| B. | CH2═CH2+HCl$\stackrel{一定条件}{→}$CH3-CH2Cl | |
| C. | CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O | |
| D. | CH4+Cl2$\stackrel{光照}{?}$CH3Cl+HCl |
| A. | CH3-CH═CH2 | B. | CH3-CH2-CH═CH2 | C. |  | D. | CH2═CH-CH═CH2 |
| A. | Na、Mg、Al还原性依次增强 | B. | I2、Br2、Cl2氧化性依次减弱 | ||
| C. | C、N、O原子半径依次减小 | D. | P、S、F最高正价依次降低 |
| A. | 戊二醛分子式为C5H10O2,符合此分子式的二元醛有4种 | |
| B. | 戊二醛不能在加热条件下和新制备的氢氧化铜反应 | |
| C. | 戊二醛不能使酸性KMnO4溶液褪色 | |
| D. | 2%的GA溶液能破坏菌体蛋白质,杀死微生物,具有消毒杀菌作用 |
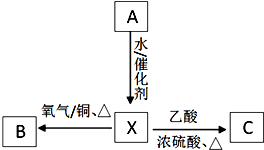 A为最简单的植物激素.有关物质的转化关系如图:
A为最简单的植物激素.有关物质的转化关系如图: