题目内容
已知有一种节能的氯碱工业新工艺,将电解池和燃料电池相组合,相关流程如图所示(电极未标出):回答下列有关问题:
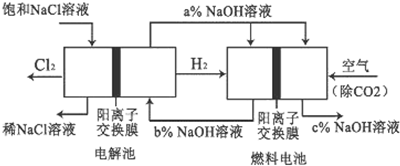
(1)燃料电池的正极反应式为 ;燃料电池中阳离子的移动方向 (“从左向右”或“从右向左”).
(2)电解池中阳离子交换膜的作用(写出两点)
(3)电解池中产生2mol Cl2,理论上燃料电池中消耗 mol O2.
(4)a、b、c的大小关系为: .

(1)燃料电池的正极反应式为
(2)电解池中阳离子交换膜的作用(写出两点)
(3)电解池中产生2mol Cl2,理论上燃料电池中消耗
(4)a、b、c的大小关系为:
考点:电解原理
专题:电化学专题
分析:(1)电解池中生成氢气的一端为电解池的阴极,溶液中氢离子得到电子生成氢气;空气中氧气在正极上得到电子生成氢氧根离子,燃料电池中阳离子移向正极;
(2)阳离子交换膜只能阳离子通过,阴离子和气体不能通过;
(3)依据电解池和原电池中电子守恒计算得到;
(4)燃料电池中的离子膜只允许阳离子通过,而燃料电池中正极氧气得到电子产生OH-,所以反应后氢氧化钠的浓度升高,即a%小于b%,可知NaOH浓度增大;依据滴定实验分析玻璃仪器.
(2)阳离子交换膜只能阳离子通过,阴离子和气体不能通过;
(3)依据电解池和原电池中电子守恒计算得到;
(4)燃料电池中的离子膜只允许阳离子通过,而燃料电池中正极氧气得到电子产生OH-,所以反应后氢氧化钠的浓度升高,即a%小于b%,可知NaOH浓度增大;依据滴定实验分析玻璃仪器.
解答:
解:(1)燃料电池的工作原理:负极是燃料氢气发生失电子的氧化反应,即H2-2e-+2OH-=2H2O,正极是氧气发生得电子得还原反应,即O2+4e-+2H2O=4OH-,通空气的电极为正极;原电池中,阳离子交换膜使阳离子通过,阳离子移向正极;
故答案为:2H2O+O2+4e-=4OH-;从左向右;
(2)阳离子交换膜只能阳离子通过,阴离子和气体不能通过,用石墨作电解电解饱和氯化钠时,阳极上氯离子放电生成氯气,氯气不能通过阳离子交换膜而进入阴极,如果氯气进入阴极易和氢气混合产生爆炸,且易和氢氧化钠溶液反应生成氯化钠、次氯酸钠而导致制取的氢氧化钠不纯;
故答案为:防止阳极生成的氯气与阴极生成的氢氧化钠反应而使产品不纯;防止阳极生成的氯气与阴极生成的氢气反应遇火反应而引发安全事故;
(3)电解池中产生2mol Cl2,依据电子守恒,O2+4e-+2H2O=4OH-,4Cl--4e-=2Cl2↑,得到2Cl2~O2,计算得到生成氧气1mol;
故答案为:1;
(4)燃料电池中的离子膜只允许阳离子通过,而燃料电池中正极氧气得到电子产生OH-,所以反应后氢氧化钠的浓度升高,即a%小于c%,负极氢气失电子生成氢离子消耗氢氧根离子,所以b%<a%,得到b%<a%<c%,
故答案为:c>a>b.
故答案为:2H2O+O2+4e-=4OH-;从左向右;
(2)阳离子交换膜只能阳离子通过,阴离子和气体不能通过,用石墨作电解电解饱和氯化钠时,阳极上氯离子放电生成氯气,氯气不能通过阳离子交换膜而进入阴极,如果氯气进入阴极易和氢气混合产生爆炸,且易和氢氧化钠溶液反应生成氯化钠、次氯酸钠而导致制取的氢氧化钠不纯;
故答案为:防止阳极生成的氯气与阴极生成的氢氧化钠反应而使产品不纯;防止阳极生成的氯气与阴极生成的氢气反应遇火反应而引发安全事故;
(3)电解池中产生2mol Cl2,依据电子守恒,O2+4e-+2H2O=4OH-,4Cl--4e-=2Cl2↑,得到2Cl2~O2,计算得到生成氧气1mol;
故答案为:1;
(4)燃料电池中的离子膜只允许阳离子通过,而燃料电池中正极氧气得到电子产生OH-,所以反应后氢氧化钠的浓度升高,即a%小于c%,负极氢气失电子生成氢离子消耗氢氧根离子,所以b%<a%,得到b%<a%<c%,
故答案为:c>a>b.
点评:本题考查原电池、电解池原理应用,电极判断和电极反应书写,注意电极反应的环境判断书写产物,题目难度中等.

练习册系列答案
相关题目
某透明的溶液中加入铝粉能放出氢气,此溶液中一定能大量共存的离子组是( )
| A、K+、Cu2+、Cl-、SO42- |
| B、HCO3-、NO3-、SO42-、Na+ |
| C、Cl-、SO42-、K+、Na+ |
| D、Na+、SO42-、Cl-、AlO2- |
已知25℃时,氢氟酸的电离平衡常数KaHF=3.6×10-4,CaF2的溶度积常数Ksp(CaF2)=1.46×10-10,现向1L 0.2mol?L-1HF溶液中加入1L 0.2mol?L-1CaCl2溶液,则下列说法中,正确的是( )
| A、25℃时,0.1mol?L-1HF 溶液中pH=2 |
| B、Ksp(CaF2)随温度和浓度的变化而变化 |
| C、该体系中没有沉淀产生 |
| D、该体系中HF与CaCl2反应产生沉淀 |
下列分子中的所有原子都在同一平面的是( )
| A、环己烷 | B、溴苯 | C、丙烯 | D、丁炔 |
下列说法中正确的是( )
①钠在空气中燃烧生成淡黄色的Na2O2;
②酸雨是pH<7的雨水;
③铝 铁 铜,三者对应的氧化物均为碱性氧化物;
④金属钠着火时用细沙子扑灭;
⑤SO2能使酸性高锰酸钾溶液褪色,所以它具有漂白性.
①钠在空气中燃烧生成淡黄色的Na2O2;
②酸雨是pH<7的雨水;
③铝 铁 铜,三者对应的氧化物均为碱性氧化物;
④金属钠着火时用细沙子扑灭;
⑤SO2能使酸性高锰酸钾溶液褪色,所以它具有漂白性.
| A、②③ | B、①②③ |
| C、①④ | D、①②③⑤ |
下列实验操作及结论都正确的是( )
| A、制取氢氧化铁胶体,可向沸水中加入FeCl3溶液 |
| B、加热蒸发NaHCO3溶液,最终可获得NaOH固体 |
| C、向醋酸溶液中加入固体的醋酸钠,可增大醋酸的电离度 |
| D、配制SnCl2溶液时,可加入过量的硫酸,抑制水解 |
下列说法正确的是( )
| A、25℃时、用醋酸溶液滴定等浓度NaOH溶液至pH=7,V醋酸<VNaOH |
| B、饱和小苏打溶液中:c(Na+)=c(HCO3-) |
| C、Na2CO3溶液中加入少量Ca(OH)2 固体,CO32-水解程度减小,溶液的pH 减小 |
| D、室温下,对于0.10 mol?L-1的氨水,用HNO3溶液完全中和后,溶液不显中性 |
 以下是对化学反应变化过程及结果的研究.按要求回答问题:
以下是对化学反应变化过程及结果的研究.按要求回答问题: