题目内容
17.下列说法正确的是( )| A. | 常温常压下,11.2 L甲烷气体含有的甲烷分子数为0.5NA | |
| B. | 标准状况下,22.4 L氦气与22.4 L氮气所含原子数相同 | |
| C. | 标准状况下,11.2 L CO与N2的混合气体与11.2 L O2所含分子数相同,原子数也相同 | |
| D. | 标准状况下,22.4 L CCl4中含共价键数为4NA |
分析 A.常温常压下,气体摩尔体积大于22.4L/mol;
B.标况下,22.4 L氦气与22.4 L氮气均为1mol,但前者为单原子分子,后者为双原子分子;
C.相同条件下,气体体积相同,则含有分子数目相同,均为双原子分子,则含有原子数目相等;
D.标况下,四氯化碳为液态.
解答 解:A.常温常压下,气体摩尔体积大于22.4L/mol,11.2 L甲烷气体的物质的量小于0.5mol,含有的甲烷分子数小于0.5NA,故A错误;
B.标况下,22.4 L氦气与22.4 L氮气均为1mol,但前者为单原子分子,后者为双原子分子,二者含有原子数目不相等,故B错误;
C.相同条件下,11.2 L CO与N2的混合气体与11.2 L O2所含分子数相同,均为双原子分子,则含有原子数目相等,故C正确;
D.标况下,四氯化碳为液态,22.4L四氯化碳的物质的量远远大于1mol,故D错误,
故选:C.
点评 本题考查气体摩尔体积、物质的量有关计算,注意气体摩尔体积的使用条件与对象,根据PV=nRT理解温度、压强对气体摩尔体积的影响.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.下列有关氧化还原反应的说法正确的是( )
| A. | 一定有电子得失或偏移 | B. | 氧化反应一定先于还原反应 | ||
| C. | 氧化剂发生氧化反应 | D. | 其实质是元素化合价发生变化 |
5.用NA表示阿伏德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4LH2O含有的分子数为1 NA | |
| B. | 常温常压下,10.6g Na2CO3含有的Na+离子数为0.2 NA | |
| C. | 通常状况下,1 NA 个CO2分子占有的体积为22.4L | |
| D. | 物质的量浓度为0.5mol•/L的MgCl2溶液中,含有Cl- 个数为1 NA |
12.下列表示对应化学反应的离子方程式正确的是( )
| A. | MnO2与浓盐酸反应制Cl2:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| B. | Na2O2 溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| C. | 醋酸除去水垢:2H++CaCO3═Ca2++CO2↑+H2O | |
| D. | 新制的氧化铝可溶于氢氧化钠溶液:Al2O3+2OH-═2AlO2-+H2O |
2.下列说法正确的是( )
| A. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti的质量数不同,属于两种元素 | |
| B. | ${\;}_{1}^{1}$H2、${\;}_{1}^{2}$H2、H2互为同位素 | |
| C. | 14462Sm其原子核内中子数和质子数都是62 | |
| D. | O2和O3互为同素异形体 |
6.固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,它与水反应的化学方程式为:NH5+H2O→NH3•H2O+H2↑,则下列有关说法正确的是( )
| A. | 1mol NH5中含有5NA个N-H键(NA为阿伏加德罗常数) | |
| B. | NH5中既有共价键,又有离子键 | |
| C. | NH5的电子式为: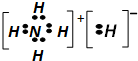 | |
| D. | 与水反应时,水作氧化剂,生成1mol氢气,转移2mol电子 |
7.在一个恒温、恒容密闭容器中,有两个可左右自由滑动的密封隔板(a、b),将容器分成三部分,已知充入的三种气体质量相等,当隔板静止时,容器内气体所占体积如图所示( 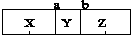 ),下列说法中错误的是( )
),下列说法中错误的是( )
 ),下列说法中错误的是( )
),下列说法中错误的是( )| A. | 若Y是C4H8,则X可能是N2 | B. | 分子数目:X=Z=2Y | ||
| C. | 若X是O2,则Z不可能是CO2 | D. | 气体密度:X=Z=2Y |