题目内容
17.乙烯是重要的有机原料,根据以下合成路线,回答问题.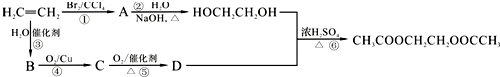
(1)写出乙烯的电子式
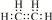 .
.(2)B分子中的官能团名称是羟基.
(3)写出指定反应的反应类型:②取代反应,③加成反应.
(4)写出指定反应的化学方程式:①CH2=CH2+Br2→CH2Br-CH2Br;⑥2CH3COOH+HOCH2CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH2OOCCH3+2H2O.
分析 根据题中各物质转化关系,乙烯与溴发生加成生成A为CH2Br-CH2Br,A发生碱性水解生成乙二醇,乙烯与水发生加成生成B为CH3CH2OH,B氧化得C为CH3CHO,C氧化得D为CH3COOH,D与乙二醇发生酯化生成,据此答题.
解答 解:根据题中各物质转化关系,乙烯与溴发生加成生成A为CH2Br-CH2Br,A发生碱性水解生成乙二醇,乙烯与水发生加成生成B为CH3CH2OH,B氧化得C为CH3CHO,C氧化得D为CH3COOH,D与乙二醇发生酯化生成,
(1)乙烯的电子式 为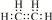 ,
,
故答案为: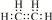 ;
;
(2)B为CH3CH2OH,B分子中的官能团名称是羟基,
故答案为:羟基;
(3)根据上面的分析可知,反应②为取代反应,反应③加成反应,
故答案为:取代反应;加成反应;
(4)反应①的化学方程式为CH2=CH2+Br2→CH2Br-CH2Br,反应⑥的化学方程式为2CH3COOH+HOCH2CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH2OOCCH3+2H2O,
故答案为:CH2=CH2+Br2→CH2Br-CH2Br;2CH3COOH+HOCH2CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH2OOCCH3+2H2O.
点评 本题考查有机物推断,涉及烯烃、醇、醛、羧酸性质与转化,注意对基础知识的理解掌握,难度不大.

练习册系列答案
相关题目
7.下列有关(NH4)2Fe(SO4)2溶液的叙述正确的是( )
| A. | 该溶液中,H+、Fe3+、Br-、NO3-可以大量共存 | |
| B. | 和足量的Ba(OH)2溶液反应的离子方程式:2NH4++Fe2++2SO42-+2Ba2++4OH-═2NH3•H2O+Fe(OH)2↓+2BaSO4↓ | |
| C. | 和KMnO4溶液反应后溶液可以褪为无色 | |
| D. | 该溶液与氢氧化钠溶液共热,产生的气体能使湿润的蓝色石蕊试纸变红 |
8.下列物质的描述和相关知识均正确的是( )
| 物质及变化 | 描述 | 相关知识 | |
| A | 碘化钾溶液滴到土豆片上 | 变蓝色 | 土豆片含淀粉 |
| B | 煤的气化 | 化学变化 | 主要反应是碳与水生成水煤气等 |
| C | 乙烯和苯 | 都能使溴水褪色 | 分子中含有相同的碳碳双键 |
| D | 蔗糖和麦芽糖 | 多糖 | 二者互为同分异构体 |
| A. | A | B. | B | C. | C | D. | D |
12.下列关于卤素的说法中,正确的是( )
| A. | 单质的密度随核电荷数的增加逐渐减小 | |
| B. | 单质的颜色随核电荷数的增加而逐渐变浅 | |
| C. | 单质的氧化性随核电荷数的增加而逐渐减弱 | |
| D. | 氢化物的稳定性随核电荷数的增加逐渐增强 |
2.下列关于卤代烃的叙述中正确的是( )
| A. | 所有卤代烃都是无色、难溶于水,比水重的液体 | |
| B. | 所有卤代烃在适当条件下都能发生取代反应 | |
| C. | 所有卤代烃在适当条件下都能发生消去反应 | |
| D. | 氟氯代烷(即氟利昂)是优良的制冷剂、灭火剂,需推广使用 |
9.烟气中含有SO2等大量有害的物质,烟气除硫的方法有多种,其中石灰石法烟气除硫工艺的主要反应如下:
Ⅰ.CaCO3(s)?CO2(g)+CaO(s)△H=+178.2kJ/mol
Ⅱ.SO2(g)+CaO(s)?CaSO3(s)△H=-402kJ/mol
Ⅲ.2CaSO3(s)+O2(g)+4H2O(l)?2[CaSO4•2H2O](s)△H=-234.2kJ/mol
(1)试写出由石灰石、二氧化硫、氧气和水反应生成生石膏的热化学方程式2CaCO3(s)+O2(g)+2SO2(g)+4H2O(l)?2[CaSO4.2H2O](s)+2CO2(g)△H=-681.8kJ/mol.

甲乙两同学分别对含+4价硫元素的物质性质进行了探究.
(2)甲用右图装置进行实验(气密性已检验,加热和夹持装置已略去).实验进行一段时间后,C、D中都出现明显的白色沉淀,经检验均为BaSO4.
①A中反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
②为探究SO2在D中所发生的反应,甲进一步实验发现,出现白色沉淀的过程中,D溶液中NO3-浓度几乎不变.甲据此得出结论:D中出现白色沉淀的主要原因是酸性条件下,含+4价硫元素物质(SO2或H2SO3)被O2氧化生成SO42-.
(3)乙用如下实验对含+4价硫元素的物质性质继续进行探究.
①用化学方程式解释实验1中产生现象的原因:2H++SO32-═SO2+H2O,2SO2+O2+2Ba2++2H2O═2BaSO4↓+4H+或2H2SO3+O2+2Ba2+═2BaSO4↓+4H+.
②由实验1、2、3对比,可以得到推论含+4价硫元素物质可被O2和浓HNO3氧化.
③乙通过查阅资料发现,Na+对实验1和2中出现浑浊的时间无影响,于是进一步探究Cl-和NO3-对其的影响:
i.实验2和4对比,乙获得推论:Cl-的存在可以加快溶液中+4价硫元素的氧化;
ii.实验1和4对比,乙获得推论:硝酸根离子减慢+4价硫的化合物的氧化;.
(4)已知,25℃时,BaSO4的Ksp为1×10-10,硫酸钡的溶解度约是2.33×10-4g.
Ⅰ.CaCO3(s)?CO2(g)+CaO(s)△H=+178.2kJ/mol
Ⅱ.SO2(g)+CaO(s)?CaSO3(s)△H=-402kJ/mol
Ⅲ.2CaSO3(s)+O2(g)+4H2O(l)?2[CaSO4•2H2O](s)△H=-234.2kJ/mol
(1)试写出由石灰石、二氧化硫、氧气和水反应生成生石膏的热化学方程式2CaCO3(s)+O2(g)+2SO2(g)+4H2O(l)?2[CaSO4.2H2O](s)+2CO2(g)△H=-681.8kJ/mol.

甲乙两同学分别对含+4价硫元素的物质性质进行了探究.
(2)甲用右图装置进行实验(气密性已检验,加热和夹持装置已略去).实验进行一段时间后,C、D中都出现明显的白色沉淀,经检验均为BaSO4.
①A中反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
②为探究SO2在D中所发生的反应,甲进一步实验发现,出现白色沉淀的过程中,D溶液中NO3-浓度几乎不变.甲据此得出结论:D中出现白色沉淀的主要原因是酸性条件下,含+4价硫元素物质(SO2或H2SO3)被O2氧化生成SO42-.
(3)乙用如下实验对含+4价硫元素的物质性质继续进行探究.
| 序号 | 实验操作 | 实验现象 |
| 1 | 取0.3g 纯净Na2SO3固体,向其中加入10mL2mol•L-1盐酸,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,4min后,溶液变浑浊 |
| 2 | 取0.3g 纯净Na2SO3固体,向其中加入10mL 2mol•L-1 HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,2h后,溶液变浑浊 |
| 3 | 取0.3g 纯净Na2SO3固体,向其中加入10mL 浓HNO3,再滴入4滴BaCl2溶液 | 产生红棕色气体;滴入BaCl2溶液后,溶液立即产生大量白色沉淀 |
②由实验1、2、3对比,可以得到推论含+4价硫元素物质可被O2和浓HNO3氧化.
③乙通过查阅资料发现,Na+对实验1和2中出现浑浊的时间无影响,于是进一步探究Cl-和NO3-对其的影响:
| 序号 | 实验操作 | 实验现象 |
| 4 | 取固体混合物,向其中加入10mL2mol•L-1 HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,20min后,溶液变浑浊 |
ii.实验1和4对比,乙获得推论:硝酸根离子减慢+4价硫的化合物的氧化;.
(4)已知,25℃时,BaSO4的Ksp为1×10-10,硫酸钡的溶解度约是2.33×10-4g.
20.甲、乙分别是由同主族元素R、Z组成的两种单质,常温下能进行如下反应:甲+乙+H2O→HRO3+HZ(未配平).下列说法不正确的是( )
| A. | 制备1mol HRO3转移电子数一定为2NA | |
| B. | R、Z简单离子的还原性:Z(离子)<R(离子) | |
| C. | HZ分子的稳定性大于HR分子 | |
| D. | HRO3与HZ计量数之比为1:5 |
