��Ŀ����
��1��ij�¶��£���Ca��OH��2��Ksp=5.5��10-6����Mg��OH��2��Ksp=3.2��10-11����AgCl��Ksp=1.8��10-10�����������У��ܽ����С���� ��
��2���ڴ���CuSO4?5H2O�����г���������Fe2+�����ᴿʱΪ�˳�ȥFe2+����������������ʹFe2+����ΪFe3+��������������ʵ��� ��
A��KMnO4 �� B��H2O2 ���� C��Cl2 ˮ ���� D��HNO3
Ȼ���ټ����ʵ����ʵ�������ҺpH=4��ʹFe3+ת��ΪFe��OH��3�����Դﵽ��ȥFe3+������ʧCuSO4��Ŀ�ģ�������ҺpH��ѡ�������е� ��
A��NaOH B�� NH3?H2O C��CuCO3 D��Cu��OH��2
��3����ͬѧ���ɵ�������ҺpH=4�Ƿ��ܴﵽ��ȥFe3+������ʧCu2+��Ŀ�ģ���ͬѧ��Ϊ����ͨ������ȷ�����������й����ϵõ��������ݣ�������Fe��OH��3���ܶȻ�Ksp=8.0��10-38��Cu��OH��2���ܶȻ�Ksp=3.0��10-18��ͨ����Ϊ��������Һ�е�����Ũ��С��1��10-5 mol?L-1ʱ����Ϊ������ȫ������Һ��CuSO4��Ũ��Ϊ3.0mol?L-1����Cu��OH��2��ʼ����ʱ��Һ��pHΪ ��Fe3+��ȫ����ʱ��Һ��pHΪ ����֪lg2=0.3��lg5=0.7����ͨ������ȷ���������� ������С������С���
��2���ڴ���CuSO4?5H2O�����г���������Fe2+�����ᴿʱΪ�˳�ȥFe2+����������������ʹFe2+����ΪFe3+��������������ʵ���
A��KMnO4 �� B��H2O2 ���� C��Cl2 ˮ ���� D��HNO3
Ȼ���ټ����ʵ����ʵ�������ҺpH=4��ʹFe3+ת��ΪFe��OH��3�����Դﵽ��ȥFe3+������ʧCuSO4��Ŀ�ģ�������ҺpH��ѡ�������е�
A��NaOH B�� NH3?H2O C��CuCO3 D��Cu��OH��2
��3����ͬѧ���ɵ�������ҺpH=4�Ƿ��ܴﵽ��ȥFe3+������ʧCu2+��Ŀ�ģ���ͬѧ��Ϊ����ͨ������ȷ�����������й����ϵõ��������ݣ�������Fe��OH��3���ܶȻ�Ksp=8.0��10-38��Cu��OH��2���ܶȻ�Ksp=3.0��10-18��ͨ����Ϊ��������Һ�е�����Ũ��С��1��10-5 mol?L-1ʱ����Ϊ������ȫ������Һ��CuSO4��Ũ��Ϊ3.0mol?L-1����Cu��OH��2��ʼ����ʱ��Һ��pHΪ
���㣺���ܵ���ʵ��ܽ�ƽ�⼰����ת���ı���,���κ������ε��ת��
ר�⣺����ƽ������Һ��pHר��
��������1����ѧʽ���Ƶ����ʵ��ܶȻ�����ԽС������Խ���ܣ��ܽ��ԽС��
��2�����������������ʹFe2+����ΪFe3+�����������µ����ʣ���������ҺpH=4��ʹFe3+ת��ΪFe��OH��3�����Դﵽ��ȥFe3+������ʧCuSO4��Ŀ�ģ���Ӻ�ͭԪ�ص������������ӷ�Ӧ�ٽ�������ˮ��ת��Ϊ������
��3������������ͭ������Һ���ܶȻ�����������Һ�е�������Ũ�ȼ���PH��������������ܶȻ��Ͳ�������Һ�е�����Ũ��С��1��10-5 mol?L-1ʱ����Ϊ������ȫ��
��2�����������������ʹFe2+����ΪFe3+�����������µ����ʣ���������ҺpH=4��ʹFe3+ת��ΪFe��OH��3�����Դﵽ��ȥFe3+������ʧCuSO4��Ŀ�ģ���Ӻ�ͭԪ�ص������������ӷ�Ӧ�ٽ�������ˮ��ת��Ϊ������
��3������������ͭ������Һ���ܶȻ�����������Һ�е�������Ũ�ȼ���PH��������������ܶȻ��Ͳ�������Һ�е�����Ũ��С��1��10-5 mol?L-1ʱ����Ϊ������ȫ��
���
�⣺��1����ѧʽ���Ƶ����ʵ��ܶȻ�����ԽС������Խ���ܣ��ܽ��ԽС����֪��������ˮ���ܽ�����Ca��OH��2��Mg��OH��2��AgCl�У�c��Ag+��=
��1��10-5��Mg��OH��2��c��Mg2+��=
��1��10-4����Mg��OH��2A�ܽ�ȴ��ܽ����С����AgCl���ʴ�Ϊ��AgCl��
��2�����������������ʹFe2+����ΪFe3+�����������µ����ʣ�A��C��D�л��������ʣ�ֻ�й�������Ļ�ԭ����Ϊˮ�����������ʣ���ֻ��B���ϣ�
��������ҺpH=4��ʹFe3+ת��ΪFe��OH��3�����Դﵽ��ȥFe3+������ʧCuSO4��Ŀ�ģ���Ӻ�ͭԪ�ص������������ӷ�Ӧ�ٽ�������ˮ��ת��Ϊ��������C��D���ɣ�A��B��ͭ����ת��Ϊ�����������ϣ�
�ʴ�Ϊ��B��CD��
��3��Cu��OH��2���ܶȻ�Ksp=3.0��10-18����Һ��CuSO4��Ũ��Ϊ3.0mol?L-1��c��Cu2+��=3.0mol?L-1��
�����ܶȻ�����c��Cu2+����c2��OH-��=3.0��10-18��c2��OH-��=
=10-18��
�õ�c��OH-��=10-9mol/L��
����ˮ��Һ�е����ӻ�c��H+����c��OH-��=10-14��c��H+��=10-5mol/L����ҺpH=5��
��Cu��OH��2��ʼ����ʱ��Һ��pHΪ4����������Һ�е�����Ũ��С��1��10-5 mol?L-1ʱ����Ϊ������ȫ��Fe��OH��3���ܶȻ�Ksp=8.0��10-38��c��Fe3+����c3��OH-��=8.0��10-38��c3��OH-��=
=8.0��10-33�����c��OH-��=2��10-11mol/L��ˮ��Һ�е����ӻ�c��H+����c��OH-��=10-14��c��H+��=5��10-4mol/L����pH=3.3��ͨ�������֪pH=4�ܴﵽ��ȥFe3+������ʧCu2+��Ŀ�ģ������У�
�ʴ�Ϊ��5��3.3�����У�
| 1.8��10-10 |
| 3 | 3.2��10-11 |
��2�����������������ʹFe2+����ΪFe3+�����������µ����ʣ�A��C��D�л��������ʣ�ֻ�й�������Ļ�ԭ����Ϊˮ�����������ʣ���ֻ��B���ϣ�
��������ҺpH=4��ʹFe3+ת��ΪFe��OH��3�����Դﵽ��ȥFe3+������ʧCuSO4��Ŀ�ģ���Ӻ�ͭԪ�ص������������ӷ�Ӧ�ٽ�������ˮ��ת��Ϊ��������C��D���ɣ�A��B��ͭ����ת��Ϊ�����������ϣ�
�ʴ�Ϊ��B��CD��
��3��Cu��OH��2���ܶȻ�Ksp=3.0��10-18����Һ��CuSO4��Ũ��Ϊ3.0mol?L-1��c��Cu2+��=3.0mol?L-1��
�����ܶȻ�����c��Cu2+����c2��OH-��=3.0��10-18��c2��OH-��=
| 3.0��10-18 |
| 3.0 |
�õ�c��OH-��=10-9mol/L��
����ˮ��Һ�е����ӻ�c��H+����c��OH-��=10-14��c��H+��=10-5mol/L����ҺpH=5��
��Cu��OH��2��ʼ����ʱ��Һ��pHΪ4����������Һ�е�����Ũ��С��1��10-5 mol?L-1ʱ����Ϊ������ȫ��Fe��OH��3���ܶȻ�Ksp=8.0��10-38��c��Fe3+����c3��OH-��=8.0��10-38��c3��OH-��=
| 8.0��10-38 |
| 1��10-5 |
�ʴ�Ϊ��5��3.3�����У�
���������⿼�����ʷ����ᴿ������ѡ���Ӧ�ã��漰����ˮ�⣬ע�ظ�Ƶ����Ŀ��飬��Ŀ�ѶȲ���

��ϰ��ϵ�д�
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
�����Ŀ
��ͼ��ʾװ�ÿ�������������ϴ�ӡ�����ռ���������β�����������壬��װ�ÿ����ڣ�������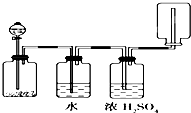

| A��KMnO4�ֽ��������� |
| B���������̺������������� |
| C��̼��ƺ��������ɶ�����̼ |
| D��������������� |
��������ʯ�ҷ�������ˮ�У�һ��ʱ���ﵽƽ�⣺Ca��OH��2��s��?Ca2+��aq��+2OH-��aq��������������ȷ���ǣ�������
| A������Һ���ȣ���Һ��pH���� |
| B������������Һ�м���CaO����Һn��Ca2+������ |
| C������Һ�м���Na2CO3��Һ�������е�Ca��OH��2�Ĺ������� |
| D������Һ�м���������NaOH���壬�����е�Ca��OH��2�Ĺ������� |
�������ӷ���ʽ��д��ȷ���ǣ�������
| A���Ȼ�����Һ�м��������ˮ��Al3++4NH3?H2O=[Al��OH��4]-+4NH4+ |
| B������ʯ��ˮ�������մ���Һ��Ӧ��Ca2++HCO3-+OH-=CaCO3��+H2O |
| C��̼������ڴ��� CaCO3+2H+=Ca2++CO2��+H2O |
| D���Ȼ�������ͨ������ 2Fe2++Cl2=2Fe3++2Cl- |
�ܱ�������mA������+nB������?pC��������ƽ����¶�һ��ʱ�����������ѹ����ԭ����һ�룬�����´�ƽ��ʱ��C��Ũ��Ϊԭ����1.9��������˵������ȷ���ǣ�������
| A��m+n��p |
| B��ƽ�����淴Ӧ�����ƶ� |
| C��Aת���ʽ��� |
| D��C������������� |

