题目内容
1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
(一)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
四种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是 ,
(二)科学家通过X射线推测胆矾的结构,按要求填空:
(1)金属铜采用下列 堆积方式.配位数为 .

(2)Cu2+还能与NH3、Cl-等形成配位数为4的配合物.
①[Cu(NH3)4]2+中存在的化学键类型有 (填序号).
A.配位键 B.离子键 C.极性共价键 D.非极性共价键
②已知[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为 .
(3)实验证明,用蒸汽密度法测得的H2O的相对分子质量比用化学式计算出来的相对分子质量要大,其原因是 .
(一)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ?mol-1) | 786 | 715 | 3401 |
(二)科学家通过X射线推测胆矾的结构,按要求填空:
(1)金属铜采用下列

(2)Cu2+还能与NH3、Cl-等形成配位数为4的配合物.
①[Cu(NH3)4]2+中存在的化学键类型有
A.配位键 B.离子键 C.极性共价键 D.非极性共价键
②已知[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为
(3)实验证明,用蒸汽密度法测得的H2O的相对分子质量比用化学式计算出来的相对分子质量要大,其原因是
考点:晶胞的计算,判断简单分子或离子的构型
专题:化学键与晶体结构
分析:(一)影响晶体晶格能大小的因素有离子半径以及离子所带电荷的多少,晶格能越大熔点越高;
(二)(1)Cu为面心立方密堆积,根据铜原子在晶胞中的位置可以判断出配位数;
(2)①配离子[Cu(NH3)4]2+中含有配位键,不同非金属元素之间形成极性共价键;
②形成4个配位键,具有对称的空间构型,可能为平面正方形或正四面体,如为正四面体,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,只有一种结构;
(3)因为水分子间存在氢键,氢键会使水分子成为缔合水分子,使得体积变小,所以用蒸汽密度法测得的H2O的相对分子质量比理论计算出来的相对分质量较大.
(二)(1)Cu为面心立方密堆积,根据铜原子在晶胞中的位置可以判断出配位数;
(2)①配离子[Cu(NH3)4]2+中含有配位键,不同非金属元素之间形成极性共价键;
②形成4个配位键,具有对称的空间构型,可能为平面正方形或正四面体,如为正四面体,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,只有一种结构;
(3)因为水分子间存在氢键,氢键会使水分子成为缔合水分子,使得体积变小,所以用蒸汽密度法测得的H2O的相对分子质量比理论计算出来的相对分质量较大.
解答:
解:(一)离子半径Mg2+<Na+<O2-<Ca2+<Cl-;离子电荷数Na+=Cl-<O2-=Mg2+=Ca2+,离子晶体的离子半径越小,带电荷数越多,晶格能越大,则晶体的熔沸点越高,则有NaCl、KCl、MgO、CaO熔点由高到低的顺序是MgO>CaO>NaCl>KCl,
故答案为:MgO>CaO>NaCl>KCl;
(二)(1)Cu为面心立方密堆积,故C符合,在立方体的顶点和面心都有一个铜原子,所以每个铜原子周围距离最近的铜原子个数为12,即配位数为12,
故答案为:C;12;
(2)①[Cu(NH3)4]2+中Cu2+与NH3之间的化学键为配位键,N-H为极性共价键,
故答案为:AC;
②形成4个配位键,具有对称的空间构型,可能为平面正方形或正四面体,如为正四面体,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,只有一种结构,所以应为平面正方形,
故答案为:平面正方形;
(3)因为水分子间存在氢键,氢键会使水分子成为缔合水分子,使得体积变小,所以用蒸汽密度法测得的H2O的相对分子质量比理论计算出来的相对分质量较大,
故答案为:水分子间存在氢键,氢键会使水分子成为缔合水分子,所以计算出来的相对分子质量较大.
故答案为:MgO>CaO>NaCl>KCl;
(二)(1)Cu为面心立方密堆积,故C符合,在立方体的顶点和面心都有一个铜原子,所以每个铜原子周围距离最近的铜原子个数为12,即配位数为12,
故答案为:C;12;
(2)①[Cu(NH3)4]2+中Cu2+与NH3之间的化学键为配位键,N-H为极性共价键,
故答案为:AC;
②形成4个配位键,具有对称的空间构型,可能为平面正方形或正四面体,如为正四面体,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,只有一种结构,所以应为平面正方形,
故答案为:平面正方形;
(3)因为水分子间存在氢键,氢键会使水分子成为缔合水分子,使得体积变小,所以用蒸汽密度法测得的H2O的相对分子质量比理论计算出来的相对分质量较大,
故答案为:水分子间存在氢键,氢键会使水分子成为缔合水分子,所以计算出来的相对分子质量较大.
点评:本题考查的内容较杂,涉及到离子晶体的晶格能、金属晶体结构、配合物的结构及氢键有关知识,难度不大,注重对基础知识的考查.

练习册系列答案
相关题目
下列化学用语中,书写或说法正确的是( )
A、硝基苯的结构简式: |
| B、乙醇含有的官能团是-OH,带一个单位负电荷 |
C、丙烷的球棍模型为  |
| D、乙酸的分子式:C2H4O |
将少量氯水加入盛有KBr溶液的试管中,再加入适量的汽油,然后振荡,静置,产生的现象是( )
| A、溶液呈橙色 |
| B、溶液呈无色 |
| C、上层液体呈橙色,下层液体几乎无色 |
| D、上层液体呈紫红色,下层液体几乎无色 |
若某个碳原子边连接着四个不同的原子或原子团,这种碳原子称“手性碳原子”,凡有一个手性碳原子的物质一定具有光学活性.在下列有机物中,具有光学活性的是( )
| A、CH3CH2CH3 |
| B、CH2=CHCH=CH2 |
| C、CH3CH2CH2OH |
D、 |


 燃料电池是一种连续的将燃料和氧化剂的化学能直接转化为电能的化学电池.氢气、烃、肼、甲醇等液体或气体,均可以作燃料电池的燃料.请回答下列问题:
燃料电池是一种连续的将燃料和氧化剂的化学能直接转化为电能的化学电池.氢气、烃、肼、甲醇等液体或气体,均可以作燃料电池的燃料.请回答下列问题: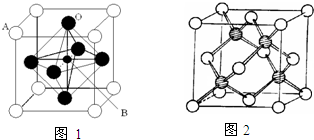 过渡金属元素氧化物的应用研究是目前科学研究的前沿之一,试回答下列问题:
过渡金属元素氧化物的应用研究是目前科学研究的前沿之一,试回答下列问题: