题目内容
有A、B、C、D、E、F、G七种元素核电荷数依次增加,A是非金属元素外围电子排布式为nsn,B的价电子层电子排布nsnnpn,C的基态原子中2p轨道有三个未成对的单电子,D是周期表中电负性数值最大的元素,E原子核外电子数是D与C核外电子数之和,F是主族元素且与G同周期,G能形成红色(或砖红色)的G2O和黑色的GO两种氧化物,D与F可形成离子化合物,其晶胞结构如图2所示.请回答下列问题.
(1)E的气态氧化物EO3分子结构模型是 .
(2)CA3极易溶于水,其原因主要是 ,试判断CA3溶于水后,形成CA3?H2O的最合理结构为 (填字母).
(3)从如图2中可以看出,D跟F形成的离子化合物的电子式为 ;该离子化合物晶体的密度为ag?cm-3,则晶胞的体积是 (只要求列出算式),每个D原子周围最近的F原子有 个.
(4)某科研小组为了处理污水,设计了如图3所示的装置,Ⅱ装置为BA4燃料电池,两电极分别通入BA4和混合气体(空气和气体甲),电解质为熔融碳酸盐.Ⅰ是污水处理的装置,其方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3?Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用,向污水中加入适量的H2SO4的目的是 .
②为了使燃料电池乙长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环的物质A为 Ⅱ装置中负极上发生的反应 .
③Ⅰ装置中碳电极是电解池的 极,Fe电极上发生的反应为 .
④Ⅱ装置中有0.8mol BA4参加反应时,C电极理论上生成气体的体积在标准状况下为 .

(1)E的气态氧化物EO3分子结构模型是
(2)CA3极易溶于水,其原因主要是
(3)从如图2中可以看出,D跟F形成的离子化合物的电子式为
(4)某科研小组为了处理污水,设计了如图3所示的装置,Ⅱ装置为BA4燃料电池,两电极分别通入BA4和混合气体(空气和气体甲),电解质为熔融碳酸盐.Ⅰ是污水处理的装置,其方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3?Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用,向污水中加入适量的H2SO4的目的是
②为了使燃料电池乙长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环的物质A为
③Ⅰ装置中碳电极是电解池的
④Ⅱ装置中有0.8mol BA4参加反应时,C电极理论上生成气体的体积在标准状况下为
考点:晶胞的计算,位置结构性质的相互关系应用,原电池和电解池的工作原理
专题:元素周期律与元素周期表专题,化学键与晶体结构,电化学专题
分析:A是非金属元素外围电子排布式为nsn,可知A只能为H元素;B的价电子层电子排布nsnnpn,n=2,则B为C元素;C的基态原子中2p轨道有三个未成对的单电子,则C为N元素;D是周期表中电负性数值最大的元素,D为F元素;E原子核外电子数是D与C核外电子数之和,E核外电子数为16,为S元素;G能形成红色(或砖红色)的G2O和黑色的GO两种氧化物,则G为Cu元素;图2晶胞中,F元素位于体内,共有8个微粒,F位于顶点和面心,数目为8×
+6×
=4,数目比为2:1,即F为+2价,又由于F是主族元素且与Cu同周期,F为Ca元素;
(1)根据气态氧化物SO3分子价电子对数判断;
(2)NH3中氮氢键极性较强,容易产生分子间氢键,根据相似相容原理判断;根据O-H键和N-H键的极性强弱判断;
(3)根据均摊法判断化学式,形成离子化合物,写出电子式;计算出晶胞摩尔质量,结合密度计算出一个晶胞体积;根据晶胞结构判断配位数;
(4)①加入适量的H2SO4的增大离子浓度,可提高导电性;
②燃料电池负极放电时,电极放电产生的CO2,且能在正极氧气放电时参与电极反应;根据燃料电池负极气体和电解质,写出电极反应式;
③根据“通过电解生成Fe(OH)3?Fe(OH)3具有吸附性”,可知Fe做阳极,C棒为阴极;Fe作阳极,失去电子,写出电极反应式;
④C电极发生反应为2H++2e-=H2↑,根据电子守恒计算生成气体体积.
| 1 |
| 8 |
| 1 |
| 2 |
(1)根据气态氧化物SO3分子价电子对数判断;
(2)NH3中氮氢键极性较强,容易产生分子间氢键,根据相似相容原理判断;根据O-H键和N-H键的极性强弱判断;
(3)根据均摊法判断化学式,形成离子化合物,写出电子式;计算出晶胞摩尔质量,结合密度计算出一个晶胞体积;根据晶胞结构判断配位数;
(4)①加入适量的H2SO4的增大离子浓度,可提高导电性;
②燃料电池负极放电时,电极放电产生的CO2,且能在正极氧气放电时参与电极反应;根据燃料电池负极气体和电解质,写出电极反应式;
③根据“通过电解生成Fe(OH)3?Fe(OH)3具有吸附性”,可知Fe做阳极,C棒为阴极;Fe作阳极,失去电子,写出电极反应式;
④C电极发生反应为2H++2e-=H2↑,根据电子守恒计算生成气体体积.
解答:
解:(1)SO3价电子对数为
=3,形成3条杂化轨道,配位原子数为3,即3条杂化轨道与3个O原子形成共价键,分子构型为平面三角形,
故答案为:平面三角形;
(2)NH3空间构型为三角锥形,属于极性分子,又由于NH3中氮氢键极性较强,容易与水形成分子间氢键;O-H键极性强于N-H键的极性,则O带有较多的“部分负电荷”,更容易与H原子形成氢键,即图1中(b)更为合理,
故答案为:极性分子并且可以形成氢键;(b);
(3)图2晶胞中,F-元素位于体内,共有8个微粒,Ca2+位于顶点和面心,数目为8×
+6×
=4,数目比为2:1,化学式为CaF2,属于离子化合物,电子式为: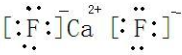 ;晶胞摩尔质量为4×(40+19×2)=312g/mol,则晶胞摩尔体积为
;晶胞摩尔质量为4×(40+19×2)=312g/mol,则晶胞摩尔体积为
L/mol,一个晶胞体积为
;Ca2+位于
晶胞体心,周围有4个F-,
故答案为: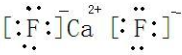 ;
;
;4;
(4)①加入适量的H2SO4的增大离子浓度,可提高导电性,故答案为:增强污水的导电性;
②燃料电池负极放电时,电极放电产生的CO2,且能在正极氧气放电时参与电极反应,即循环物质为CO2;燃料电池负极气体为CH4和电解质为熔融碳酸盐,电极反应式为CO2CH4-8e-+4CO32-═5CO2+2H2O,故答案为:CO2;CH4-8e-+4CO32-═5CO2+2H2O;
③根据“通过电解生成Fe(OH)3?Fe(OH)3具有吸附性”,可知Fe做阳极,C棒为阴极;Fe作阳极,失去电子,写出电极反应式为Fe-2e-═Fe2+,
故答案为:阴;Fe-2e-═Fe2+;
④CH4物质的量为0.8mol,在反应CH4-8e-+4CO32-═5CO2+2H2O中,转移电子数为6.4mol,根据C电极发生反应2H++2e-=H2↑,可知生成H2的物质的量为3.2mol,则标况下体积为3.2mol×22.4L/mol=71.68L,
故答案为:71.68L.
| 6 |
| 2 |
故答案为:平面三角形;
(2)NH3空间构型为三角锥形,属于极性分子,又由于NH3中氮氢键极性较强,容易与水形成分子间氢键;O-H键极性强于N-H键的极性,则O带有较多的“部分负电荷”,更容易与H原子形成氢键,即图1中(b)更为合理,
故答案为:极性分子并且可以形成氢键;(b);
(3)图2晶胞中,F-元素位于体内,共有8个微粒,Ca2+位于顶点和面心,数目为8×
| 1 |
| 8 |
| 1 |
| 2 |
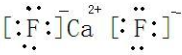 ;晶胞摩尔质量为4×(40+19×2)=312g/mol,则晶胞摩尔体积为
;晶胞摩尔质量为4×(40+19×2)=312g/mol,则晶胞摩尔体积为| 312 |
| a |
| 312 |
| aNA |
| 1 |
| 8 |
故答案为:
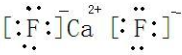 ;
;| 312 |
| aNA |
(4)①加入适量的H2SO4的增大离子浓度,可提高导电性,故答案为:增强污水的导电性;
②燃料电池负极放电时,电极放电产生的CO2,且能在正极氧气放电时参与电极反应,即循环物质为CO2;燃料电池负极气体为CH4和电解质为熔融碳酸盐,电极反应式为CO2CH4-8e-+4CO32-═5CO2+2H2O,故答案为:CO2;CH4-8e-+4CO32-═5CO2+2H2O;
③根据“通过电解生成Fe(OH)3?Fe(OH)3具有吸附性”,可知Fe做阳极,C棒为阴极;Fe作阳极,失去电子,写出电极反应式为Fe-2e-═Fe2+,
故答案为:阴;Fe-2e-═Fe2+;
④CH4物质的量为0.8mol,在反应CH4-8e-+4CO32-═5CO2+2H2O中,转移电子数为6.4mol,根据C电极发生反应2H++2e-=H2↑,可知生成H2的物质的量为3.2mol,则标况下体积为3.2mol×22.4L/mol=71.68L,
故答案为:71.68L.
点评:本题考查较为全面,涉及到分子空间构型、杂化类型的判断以及有关晶体的计算,还涉及到燃料电池和电解池相关知识,综合性较强,难度中等,如何判断分子空间构型以及有关晶体计算等方法,是该题的重点和难点.

练习册系列答案
相关题目
某烯烃与H2加成后的产物是: ,则该烯烃的结构式可能有( )
,则该烯烃的结构式可能有( )
 ,则该烯烃的结构式可能有( )
,则该烯烃的结构式可能有( )| A、3种 | B、4种 | C、5种 | D、6种 |
下列排列顺序不正确的是( )
| A、原子半径:钠>磷>氟>氢 |
| B、酸性:HClO4>H2SO4>H3PO4 |
| C、热稳定性:碘化氢>溴化氢>氟化氢 |
| D、还原性:S2->Cl->F- |
甲基带有的电荷数是( )
| A、-3 | B、0 | C、+1 | D、+3 |
 A、T、X、Y、Z是中学化学常见的四种元素,原子序数依次增大,其结构或性质信息如下表:
A、T、X、Y、Z是中学化学常见的四种元素,原子序数依次增大,其结构或性质信息如下表:
 :
:

 如图是某中学实验室的一瓶硫酸试剂标签上的部分内容.
如图是某中学实验室的一瓶硫酸试剂标签上的部分内容.
